Questões de Concurso Público UFRN 2015 para Técnico de Laboratório - Química
Foram encontradas 50 questões
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

A papaverina é uma substância obtida da papoula e apresenta a estrutura ilustrada na figura abaixo.
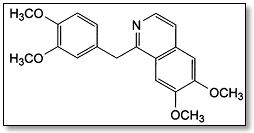
O grupo funcional predominante na papaverina é:
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Baseando-se nessa descrição, é correto afirmar que a concentração do ácido na amostra, em mol L-1 , é
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

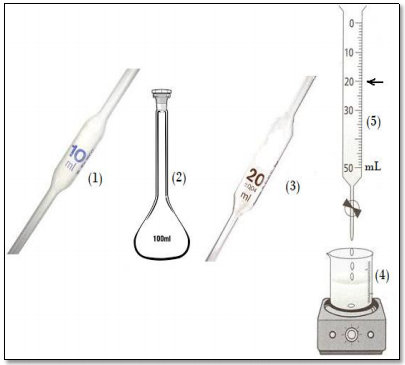
A análise volumétrica de uma determinada amostra de um ácido diprótico, com NaOH 0,100 mol L-1 , foi realizada usando-se o seguinte procedimento: inicialmente, coletou-se uma alíquota da amostra com o instrumento (1) indicado na figura ao lado; após a devida aferição de volume, a alíquota foi transferida para o instrumento (2); em seguida, o volume do instrumento (2) foi aferido com água destilada; posteriormente, uma alíquota da solução obtida foi coletada com o instrumento (3), devidamente aferido, e transferida para o instrumento (4), onde adicionou-se um indicador apropriado; ao acionar o instrumento (5), observou-se a mudança da cor da solução titulada após a adição do volume indicado pela seta.

Para a reação envolvida na titulação, devidamente balanceada, o resultado da soma dos coeficientes estequiométricos é
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Para escoar o volume de uma pipeta do tipo volumétrica, conforme a apresentada na figura, deve-se

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere as seguintes soluções.
I. Uma solução 0,1 mol L-1 de NaCl.
II. Uma solução 0,1 mol L-1 de CH3COONa.
III. Uma solução 0,1 mol L-1 de NH4Cl.
IV. Uma solução mista de CH3COOH e CH3COONa com concentrações iguais a 0,1 mol L -1 de ambas as substâncias.
Com relação ao parâmetro acidez, podemos afirmar que as soluções são, respectivamente:
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

As afirmativas a seguir referem-se a reações de neutralização.
I. Sais derivados de ácidos fortes com bases fortes se dissolvem na água para produzir íons H3O+ ou íons OH- .
II. A reação estequiométrica entre um ácido forte e uma base fraca produz uma solução ácida.
III. A reação estequiométrica entre um ácido fraco e uma base forte produz uma solução ácida.
IV. Sais derivados de ácidos ou bases fracas se dissolvem na água para produzir íons H3O+ ou íons OH- .
Dentre as afirmativas, estão corretas apenas
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

O pH ideal do plasma sanguíneo é aproximadamente 7,4. Quando, nesse meio, o pH fica menor que 6,8 ocorre acidose e quando ultrapassa 7,8 ocorre alcalose. São vários os processos que contribuem para a manutenção do pH plasmático e um dos mais importantes diz respeito ao equilíbrio mostrado a seguir:
HCO- 3 + H+ ⇆ H2CO3 ⇆ H2O + CO2
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

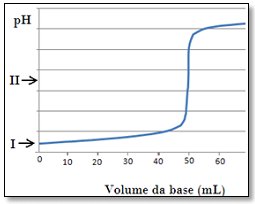
A figura apresentada ao lado representa a titulação para 100 mL de uma solução de HCl com uma solução padrão de NaOH 0,2 mol L-1 .
Os valores de pH indicados pelas setas no gráfico são, respectivamente:
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

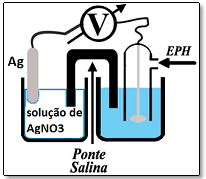
A figura exibida ao lado representa uma célula potenciométrica.
A concentração, em mol L-1 ,de íons Ag+ na solução, quando o potencial medido for igual ao potencial padrão de redução da reação estabelecida no eletrodo indicador, será
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

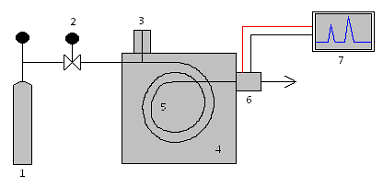
A figura representa um sistema destinado à análise por cromatografia
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5


Os dispositivos indicados pelos números 2, 4 e 6 são, respectivamente,
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5
