Questões de Concurso Público UFRN 2019 para Técnico de Laboratório - Química
Foram encontradas 28 questões
Uma amostra que pesa 1,55 g contém fósforo na forma de dihidrogenofosfato de sódio (NaH2PO4). Após receber tratamento adequado, a amostra foi misturada com solução de íons magnésio (Mg2+) e com solução de íons amônio, obtendo-se um precipitado de fosfato duplo de magnésio e amônio, conforme a reação a seguir:
H2PO4- + Mg2+ + NH4+ + 6H2O → MgNH4PO4 ˑ 6H2O(s) + 2H+
No procedimento de análise, o precipitado, após lavado e seco, foi decomposto a pirofosfato de magnésio (Mg2P2O7) conforme a reação abaixo.
2MgNH4PO4 ˑ 6H2O(s)  Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Se a massa de pirofosfato de magnésio obtida foi de 1,11 g, o teor de fósforo na amostra é
Com relação à titulação de neutralização de um ácido fraco monoprótico por uma base forte, considere as afirmativas abaixo.
I No ponto de equivalência, o ácido fraco remanesce sem se ionizar.
II No ponto de equivalência, o pH será sempre maior que 7.
III Na metade do volume para o ponto de equivalência, o pH é igual ao pKa do ácido fraco.
IV Após o ponto de equivalência, o pH corresponde ao de uma solução tampão.
Das afirmativas, estão corretas
O sulfato ferroso (FeSO4) reage com o permanganato de potássio (KMnO4) em meio ácido seguindo a reação não balanceada reproduzida abaixo.
aFeSO4(aq) + bKMnO4(aq) + cH2SO4(aq) → dFe2(SO4)3(aq) + eMnSO4(aq) + ƒK2SO4(aq) + gH2O(l)
Os coeficientes estequiométricos indicados por a e f correspondem, respectivamente, a
Considere a figura abaixo, que representa um sistema utilizado em laboratório de química.
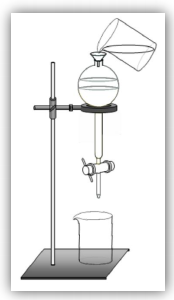
Esse sistema é útil para
Um dado importante para avaliar a qualidade da água é a determinação do índice de dureza da água, que corresponde à presença dos íons Ca2+ e Mg2+. As equações envolvidas para essa avaliação são as seguintes:
Ca2+ + H2Y2- ⇋ CaY2- + 2H+
Ca2+ + MgY2- ⇋ CaY2- + Mg2+
Mg2+ + HIn2- ⇋ MgIn- + H+
MgIn- + H2Y2- ⇋ MgY2- + HIn2- + H+
O técnico do laboratório recebeu e protocolou uma amostra de água para análise de dureza. O volume da amostra utilizado na titulação foi de 100,0 mL, e o volume de solução de EDTA 0,0100 mol L-1 gasto na titulação foi de 25,0 mL. Considere o resultado expresso em mg de CaCO3 por 1000 mL e a classificação da dureza da água, presentes na tabela abaixo.

Com base nas equações e na tabela, essa amostra é classificada como água
O técnico recebeu a tarefa de determinar o teor de vitamina C (C6H8O6 – MM=176,12 g mol-1 ) em amostra de comprimidos. Após pulverização e homogeneização pesou uma amostra de 0,1852 g do pó, transferiu para erlenmeyer e dissolveu com cerca de 20,0 mL de águ a destilada. Completada a dissolução adicionou 2,0 g de iodeto de potássio (KI) e 5 mL de ácido sulfúrico (H2SO4) 0,5 mol L-1 . Titulou com solução padrão de iodato de potássio (KIO3) 0,0250 mol L-1 , utilizando como indicador solução de amido a 1%, o volume da solução de iodato de potássio gasto foi de 13,2 mL. Considere a sequência de reações abaixo.
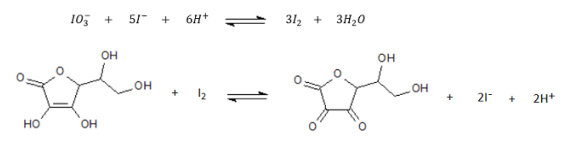
Com base nessas informações conclui-se que o teor de vitamina C no comprimido é de
aproximadamente:
Na Central Analítica do Instituto de Química da UFRN, o técnico de laboratório tem, à disposição, diversos reagentes, utensílios e equipamentos de laboratório. Baseado no princípio das técnicas instrumentais, considere os analitos e as respectivas técnicas de análise abaixo.
I NaCl em soro fisiológico por fotometria de chama e acetona em removedor de esmalte por espectrofotometria UV-VIS.
II NaF em pasta de dente por potenciometria e CaCO3 em comprimido anti-ácido por espectrometria de absorção atômica.
III NaCl em soro fisiológico por espectrofotometria UV-VIS e acetona em removedor de esmalte por espectrometria de absorção atômica.
IV NaF em pasta de dente por cromatografia gasosa e CaCO3 em comprimido anti-ácido por potenciometria.
Os itens que contêm a correlação correta entre os analitos e as respectivas técnicas são
Considere a figura abaixo que apresenta a curva de calibração obtida para a determinação de DQO pela técnica de espectrofotometria utilizando dicromato de potássio em meio ácido, bem como a equação da reta.
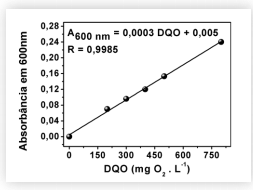
Em uma indústria de processamento de castanha de caju, coletou-se uma amostra de
efluente de 100,0 mL para análise de DQO. Após o tratamento apropriado da amostra com
dicromato de potássio em meio ácido, mediu-se a sua absorbância em 600 nm e obteve-se
um valor de 0,138. Nessa amostra, o valor de DQO em mg O2 L
-1
é
Após uma aula experimental, o técnico de laboratório armazenou uma solução 0,015 mol L-1 de KMnO4 num recipiente de prata. Nesse contexto, considere os dados abaixo.
Dados:
E°(Ag+ /Ag0 )= 0,880 V e E°(MnO4- /Mn2+) = 1,510 V
∆G° = -n F ∆E° (sendo n o número de elétrons e F a constante de Faraday - 96450 C mol-1 )
Com base nesses dados e de acordo com os valores dos potenciais padrão de redução para
as duas semi-reações da célula eletroquímica, o recipiente de prata é
Dentre os diversos métodos de calibração utilizados nas determinações analíticas , o método do padrão interno, quando empregado adequadamente, pode compensar diversos tipos de erros, quer sejam estes aleatórios ou sistemáticos. Tendo como base esse método de calibração, considere as afirmativas abaixo.
I Um padrão interno é uma substância que é adicionada em quantidade constante na amostra, no branco e nos padrões de calibração de uma análise.
II Para escolha do padrão interno, este deve apresentar propriedades físicas e químicas diferentes do analito.
III Se o padrão interno não for tomado como um constituinte principal na amostra, es te não deve estar presente na matriz da amostra, de forma que a única fonte desse padrão seja a quantidade adicionada.
IV Se, durante as etapas de preparação da amostra, que antecedem à análise, ocorrer uma perda de amostra, o uso de padrão interno não é recomendado.
Das afirmativas, estão corretas
A padronização do permanganato de potássio foi realizada utilizando-se o padrão primário oxalato de sódio e a titulação espectrofotométrica conforme a seguinte reação:
2KMnO4(aq) + 8H2SO4(aq) + 5Na2C2O4(aq) → 5Na2SO4(aq) + K2SO4(aq) + 2MnSO4(aq) + 10CO2(g) + 8 H2O(l)
Pesou-se 0,1985g de oxalato de sódio diluindo-o em 50 mL de solução de ácido sulfúrico pH 2,5. Em seguida, monitorou-se a absorbância em λ = 545 nm registrando-se os seus valores em função do volume de KMnO4 adicionado.
Sabendo-se que a única espécie que absorve a luz, nesse comprimento de onda, é o
permanganato de potássio, o perfil característico dessa titulação está em
A espectrometria de absorção atômica é o método mais utilizado para a determinação de elementos individuais em diversos tipos de amostras. Com relação aos atomizadores, considere as afirmativas abaixo.
I Em um atomizador por chama, uma amostra sólida é nebulizada por um fluxo de oxidante gasoso, misturado com um combustível também gasoso e levado à chama, onde ocorre a atomização.
II Para atingir a máxima sensibilidade analítica, a chama necessita ser ajustada, movendo-a para cima e para baixo em relação ao feixe de radiação até que a região de absorbância máxima seja localizada.
III Nos atomizadores eletrotérmicos, alguns poucos microlitros de amostra são inseridos em um tubo de grafite eletricamente aquecido para que ocorra a secagem, a pirólise, a atomização seguida da limpeza e uma rampa de resfriamento.
IV Na maioria dos métodos baseados em atomizadores eletrotérmicos, as amostras são introduzidas na forma de soluções, não sendo possível fazer a análise direta de sólidos.
Das afirmativas, estão corretas
A figura abaixo mostra os pictogramas utilizados para a classificação dos resíduos perigosos frequentemente gerados em laboratórios.
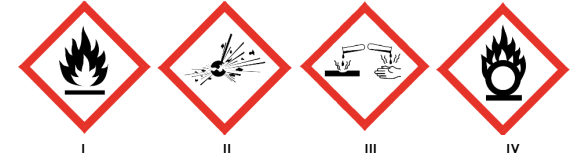
A opção que representa corretamente cada um dos pictogramas é: