Uma amostra que pesa 1,55 g contém fósforo na forma de dihid...
Uma amostra que pesa 1,55 g contém fósforo na forma de dihidrogenofosfato de sódio (NaH2PO4). Após receber tratamento adequado, a amostra foi misturada com solução de íons magnésio (Mg2+) e com solução de íons amônio, obtendo-se um precipitado de fosfato duplo de magnésio e amônio, conforme a reação a seguir:
H2PO4- + Mg2+ + NH4+ + 6H2O → MgNH4PO4 ˑ 6H2O(s) + 2H+
No procedimento de análise, o precipitado, após lavado e seco, foi decomposto a pirofosfato de magnésio (Mg2P2O7) conforme a reação abaixo.
2MgNH4PO4 ˑ 6H2O(s) 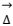 Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Se a massa de pirofosfato de magnésio obtida foi de 1,11 g, o teor de fósforo na amostra é