Questões de Concurso Público UFPI 2023 para Técnico de Laboratório - Química
Foram encontradas 30 questões
I. Os efluentes não poderão conferir ao corpo receptor características de qualidade em desacordo com as metas obrigatórias progressivas, intermediárias e final do seu enquadramento;
II. O estudo de capacidade de suporte deve considerar, no mínimo, a diferença entre os padrões estabelecidos pela classe e as concentrações existentes no trecho desde a montante, estimando a concentração após a zona de mistura;
III. É vedado, nos efluentes, o lançamento dos Poluentes Orgânicos Persistentes - POPs, observada a legislação em vigor;
IV. O lançamento de efluentes em corpos de água, com exceção daqueles enquadrados na classe especial, não poderá exceder as condições e padrões de qualidade de água estabelecidos para as respectivas classes.
Assinale a opção CORRETA:
I. Suporta elevadas temperaturas, tem formato arredondado e permite aquecimento uniforme. Essa vidraria é utilizada em processos de destilação, sistemas de evaporação a vácuo e refluxo;
II. É utilizada para medição de volumes, em que não é requerida precisão, e a presença de um bico facilita a transferência de líquidos. Essa vidraria é de uso geral e é útil para realizar misturas e dissolver substâncias em experimentos;
III. É utilizada para medir e transferir líquidos, podendo ser possível controlar o escoamento do material, rápido ou por gotejamento, pois a torneira na extremidade da vidraria permite fazer esse controle. Essa vidraria é amplamente utilizada em titulações, para comportar a substância titulante;
IV. É utilizada para preparar soluções, armazená-las e realizar experimentos que necessitem de aquecimento. Em processos de titulação, essa vidraria geralmente é utilizada para comportar a substância que vai ser titulada.
Com base na análise dos itens I a IV, assinale a opção CORRETA:
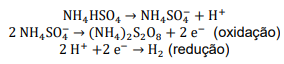
A hidrólise do persulfato de amônio forma H2O2:
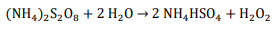
Se a eficiência do processo eletrolítico é de 60% assinale a opção que mostra a INTENSIDADE DE CORRENTE necessária para produzir 97 g de H2O2 por hora: Dados eventualmente necessários: constante de Faraday = 96500 C/mol; massas molares (g/mol): N = 14; O = 16; H = 1; S = 32.
Um frasco contém uma mistura em equilíbrio de X2(g) e X atômico, segundo a reação:
X2(g) ⇌ 2 X(g)
A pressão de equilíbrio encontrada foi de 2,4 atm em certa condição de temperatura e volume. Se X2 gasoso a
uma pressão parcial de 3 atm for adicionado à mistura em equilíbrio acima, a volume e temperatura constantes,
a nova pressão de equilíbrio será de 5,66 atm, sendo que, no processo, a pressão do X (g) atômico aumenta
65% em relação ao valor da condição inicial. Nestas condições, assinale a opção que mostra O VALOR MAIS
PRÓXIMO DE Kp para a decomposição de X2(g), na mesma temperatura:
Dados eventualmente necessários: massas molares (g/mol): A = 23; C = 12; O = 16; Cl = 35,5; H = 1.
Após a leitura, assinale a opção que mostra O SOMATÓRIO DOS COEFICIENTES ESTEQUIOMÉTRICOS, expressos com os menores inteiros, da reação citada na etapa 1 acima, A GEOMETRIA MOLECULAR da arsina e o ESTADO DE OXIDAÇÃO (Nox) do arsênio no ácido arsênico, respectivamente: