Questões de Concurso Público UFPI 2023 para Técnico de Laboratório - Química
Foram encontradas 30 questões
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
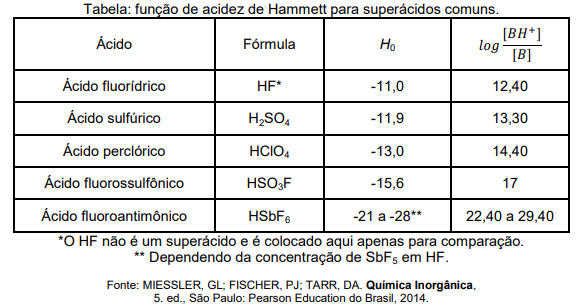
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
Diante das informações, assinale a opção que mostra o valor do pH (após o equilíbrio) de uma solução em que são adicionados 0,01 mol/L de Zn2+ e 0,02 mol/L de OH- , a 25 °C: Dados eventualmente necessários: Kw (H2O), a 25 °C = 1,00 x 10-14; (3)1/3 = 1,44; log (1,44) = 0,16; log (2,88) = 0,46; (6)1/2 = 2,45; log (2,45) = 0,39; log (4,9) = 0,69.
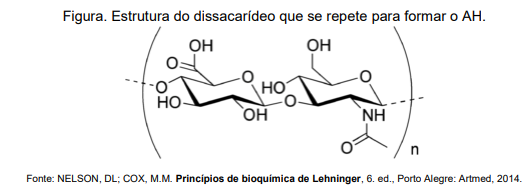
O AH é altamente hidrofílico e capaz de reter grandes quantidades de água, o que lhe confere propriedades viscoelásticas e lubrificantes. Na pele, por exemplo, ele é responsável por manter a hidratação e elasticidade, além de ajudar a preencher o meio extracelular, o que contribui para a uniformidade da superfície cutânea.
Sobre a química do AH e a partir dos seus conhecimentos, assinale a opção CORRETA:
Fonte: https://www.uol.com.br/vivabem/noticias/redacao/2018/11/30/propaganda-de-agua-alcalina-evetada-esse-produto-tem-beneficios.htm. Acesso em 02 de abril de 2023.
Em um desses produtos apresentam-se no rótulo as informações: Classificação - água mineral alcalinobicarbonatada, fluoretada e hipotermal na fonte, pH 8,16 a 25°C. Composição Química (mg/L) - Bicarbonato = 321,20; Sódio = 115,630; Cálcio = 9,692; Sulfeto = 9,31; Cloreto = 9,29; Magnésio = 2,161; Potássio = 0,972; Bário = 0,335; Estrôncio = 0,318; Fluoreto = 0,02.
Sobre as informações acima e a partir dos seus conhecimentos, assinale a opção CORRETA:
(Dados - Massas molares (g/mol): H = 1; C =12; O = 16; Na = 23; Ca = 40; S = 32; Cl = 35,5; Mg = 24; K = 39; Ba = 137; F = 19; Sr = 87,6).
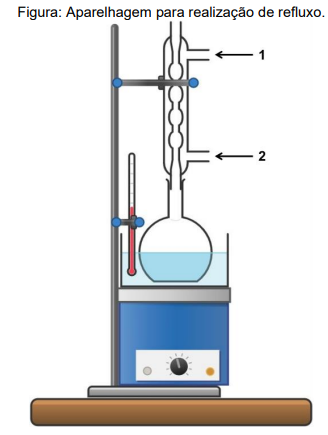
Sobre a técnica citada acima, sua aparelhagem mostrada e demais aspectos relacionados, assinale a opção CORRETA:
No contexto exposto acima, assinale a ÚNICA opção que contém o nome de um composto carbonílico que NÃO gera o íon enolato na presença de uma base forte:
Figura: Dados cinéticos para uma reação de primeira ordem. Concentração versus tempo e velocidade versus tempo.
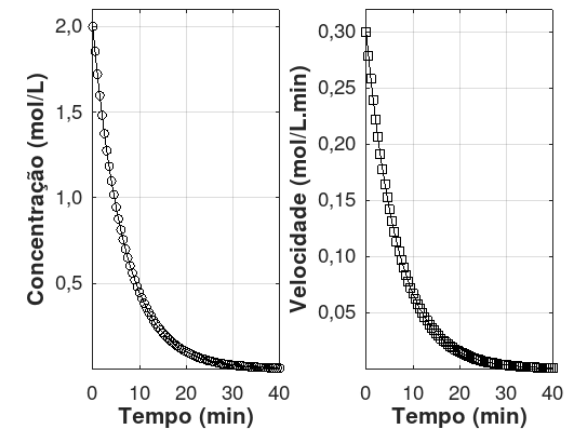
A partir da interpretação dos gráficos mostrados acima, assinale a opção que mostra corretamente O VALOR DO TEMPO DE MEIA-VIDA do processo, em minutos, com precisão de duas casas decimais: Dado: considere ln(2) = 0,693.
Diante dessas informações, assinale a opção que mostra O VALOR DA CONSTANTE DE EQUILÍBRIO, Kp, para a reação de dimerização e a afirmação CORRETA que expressa a influência da pressão (FAVORECE OU DESFAVORECE) na dimerização:
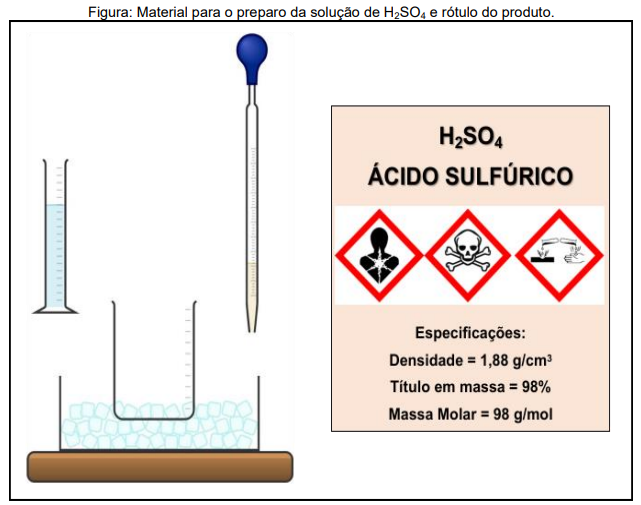
A respeito da preparação da solução de ácido sulfúrico e dos elementos na Figura acima, assinale a opção INCORRETA: Dado: considere a densidade da água = 1 g/mL.
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.
Dados eventualmente necessários: constante universal dos gases ideais, R = 8,314 J/mol.K = 2 cal/mol.K; ln(3) = 1,1; (276)-1 = 0,0036; (293)-1 = 0,0034; (313)-1 = 0,0032.
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
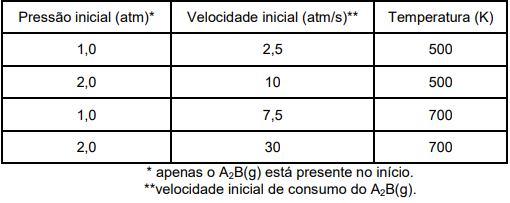
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K:
Através da corrente elétrica gerada no dispositivo é calculada a massa de álcool exalada pela pessoa. A seguir, para obter o teor de álcool no sangue do indivíduo é utilizada a correlação:
Concentração de álcool no sangue, em g/mL = 2000 x (Concentração de álcool no sopro, em g/mL). Se em um teste é realizado um sopro de 50 mL, registrando-se uma corrente de 0,2 A (ampéres) durante 30 segundos, qual o teor de álcool no sangue dessa pessoa?
Assinale a opção CORRETA: Dados eventualmente necessários: Massa molar do etanol = 46 g/mol; 1 A = 1 Coulomb/s; Constante de Faraday, F = 96500 C/(mol de e- ).
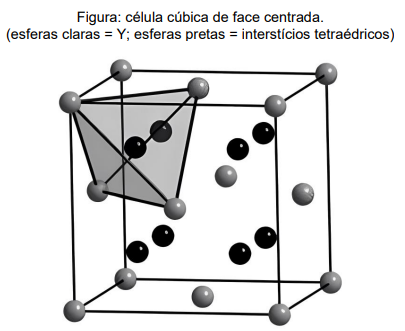
Sabe-se que, na célula apresentada, 1/8 (um oitavo) dos elementos nos vértices contribuem efetivamente para o retículo, enquanto os elementos nas faces contribuem com 1/2 (um meio). Diante das informações citadas, assinale a opção que mostra o número de INTERSTÍCIOS TETRAÉDRICOS, na célula cúbica mostrada, OCUPADOS PELO ELEMENTO X:
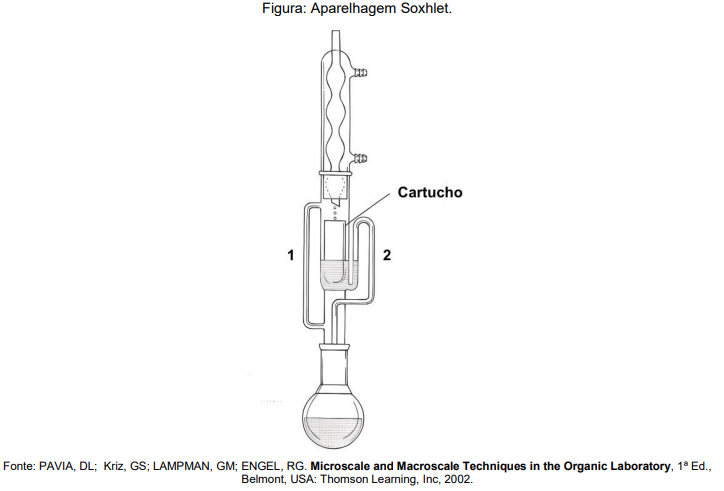
A respeito da aparelhagem mostrada e da técnica de extração com Soxhlet, assinale a opção CORRETA:
Figura: Curvas dos valores de frações em mol para: ácido carbônico - linha pontilhada; bicarbonato - linha tracejada; carbonato - linha sólida.
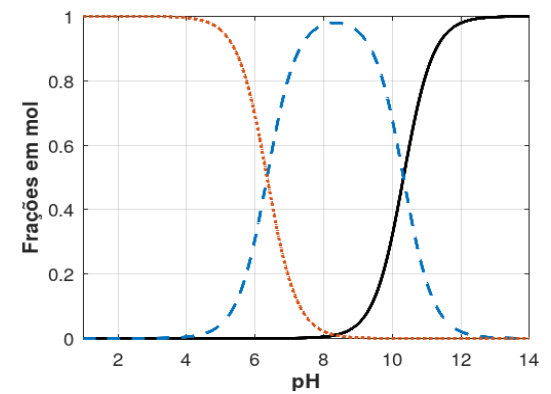
A partir das informações acima e sabendo que o Kps (constante produto de solubilidade) do CaCO3(s) (Calcita) é 4,5 x 10-9 , a 25°C , assinale a opção que mostra o valor aproximado da SOLUBILIDADE MOLAR deste carbonato, em pH 10: Dados eventualmente necessários:√4,5 = 2,12; √6,25 = 2,5; √3 = 1,73; √5 = 2,24; √10 = 3,16; √20 = 4,47.
I. A uma temperatura fixa, uma solução aquosa saturada de um determinado soluto sempre contém uma quantidade fixa desse soluto;
II. Todos os líquidos fervem a uma temperatura superior ao seu ponto de ebulição normal quando contêm impurezas não voláteis;
III. Toda solução comporta-se como uma solução ideal.
Com base na análise dos itens I, II e III, assinale a opção CORRETA:
Na sequência o iodo foi titulado com tiossulfato de sódio a 0,100 mol/L até o ponto final, com o gasto de 30,00 mL de titulante. Esta última reação foi: I2 + 2 S2O2-3(aq) ➝ 2 I-(aq) + S4O2-6(aq).
Diante das informações, assinale a opção que mostra A PORCENTAGEM EM MASSA DE ZINCO NA AMOSTRA de latão: Dados: massas molares (g/mol): Cu = 63,5; Zn = 65,4.