Questões de Concurso Público UFPE 2019 para Químico
Foram encontradas 80 questões
O composto abaixo é derivado sintético de um produto natural marinho. Possui atividade antitumoral e já está em fase de
testes para tumores de pulmão e mama.
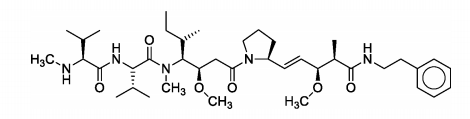
Considerando a fórmula estrutural apresentada, é incorreto afirmar que a molécula possui:
Considere o composto c/s-1-cloro-4-t-butil-cicloexano, cuja estrutura é mostrada abaixo:
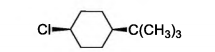
Indique a alternativa que mostra esta molécula em sua conformação mais estável.
A figura abaixo mostra as curvas de pressão de vapor versus temperatura de quatro líquidos. Um deles é a água e os
outros são os compostos orgânicos éter dietílico, etilenoglicol e etanol (não necessariamente nessa ordem):
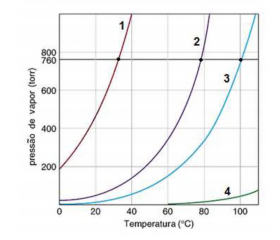
Considerando os líquidos mencionados e o gráfico apresentado, indique a alternativa incorreta.
Quando o composto p-cloro-nitrobenzeno é tratado com excesso de amônia em condições apropriadas, ocorre a formação do composto p-amino-nitrobenzeno de acordo com a reação abaixo:
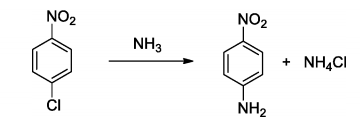
É correto afirmar que esta reação é um exemplo de:
Os oceanos possuem a capacidade de absorver certas quantidades de CO2 atmosférico através dos equilíbrios que
formam o denominado sistema carbonato:
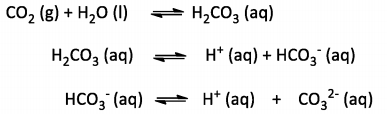
A concentração de cada espécie do sistema carbonato varia, dependendo do pH do meio. Considerando um experimento
em laboratório que simula uma condição de extrema alcalinidade (pH = 14), a espécie do sistema carbonato em maior
concentração será
O etano forma dois radicais metila, em 700 ºC, na seguinte reação de decomposição:
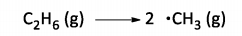
O estudo cinético desta decomposição forneceu dados que permitiram a obtenção dos gráficos abaixo:
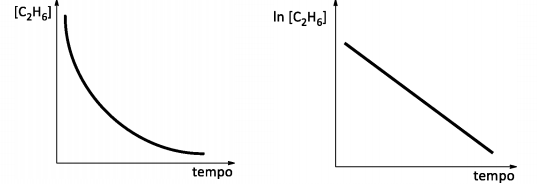
Com base nos gráficos apresentados e considerando k a constante de velocidade da reação, é correto afirmar que a lei
de velocidade da decomposição de etano para formação de radicais metila é:
O ácido fórmico pode se decompor na presença de ácidos fortes, formando monóxido de carbono, um gás altamente tóxico. O mecanismo dessa reação é apresentado abaixo:
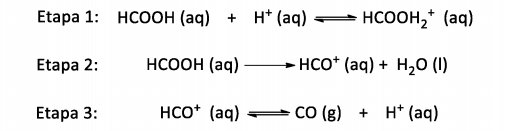
Acerca desse mecanismo, analise as afirmativas a seguir.
1) O ácido forte atua como catalisador.
2) Os cátions HCOOH2+ e HCO+ são intermediários da reação.
3) A etapa 2 é a determinante da cinética da reação.
Está(ão) correta(s):
Os dados da literatura científica mostram que K = 54, em 700 K, para a reação:

Considere uma mistura de hidrogênio, iodo e gás iodídrico em 700 K, cujas pressões parciais dos gases sejam 10 bar, 8
bar e 1 bar, respectivamente. Sobre essa mistura reacional e os valores do quociente de reação (Q) e da constante de
equilíbrio (K), é correto afirmar que:
Observe abaixo a representação do equilíbrio e da curva de solubilidade (em pmol/L) de um sal hipotético XY:
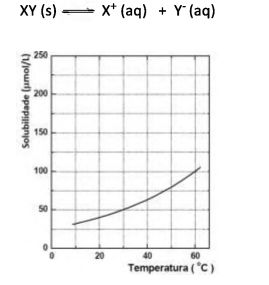
Qual é a constante do equilíbrio de solubilidade (Kps) do sal XY em 60 ºC?