Questões de Concurso Público SEGEP-MA 2016 para Analista Ambiental – Químico
Foram encontradas 33 questões
Considere as figuras abaixo.
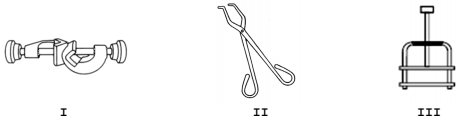
As figuras I, II e III representam, respectivamente, os seguintes materiais utilizados em laboratórios de química:
Sobre os processos de separação de misturas, considere as seguintes afirmações:
I. Grãos de areia de diferentes granulometrias podem ser separados por tamisação.
II. A separação de lipídeos de uma amostra sólida pode ser feita utilizando-se o processo de extração de Soxhlet.
III. A coluna de Vigreux pode ser utilizada como parte de uma aparelhagem de destilação fracionada.
Está correto o que se afirma em
Na padronização de uma solução de NaOH, pesou-se 0,250 g de biftalato de potássio, transferiu-se para um erlenmeyer de 250 mL e dissolveu-se em 30 mL de água destilada. Adicionou-se 2 gotas de solução indicadora de fenolftaleína e titulou-se com a solução da base, gastando-se 24,5 mL da mesma.
Dados:
Fórmula do Biftalato de potássio
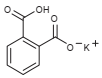
Massas Molares (g/mol): H = 1 O = 16 K = 39 C = 12 Na = 23
A concentração de NaOH em mol/L é igual a
Sobre o gás ozônio, considere as afirmações abaixo.
I. A camada de ozônio presente na estratosfera é afetada pelas emissões dos gases conhecidos como CFCs, que causam sua depleção.
II. O ozônio presente na troposfera é considerado um poluente, causando danos aos seres vivos.
III. A camada de ozônio absorve radiações ultravioleta UV-A, UV-B e UV-C provenientes do sol, impedindo-as de atingir a superfície da terra.
Está correto o que se afirma em
Na determinação de cálcio em água foram titulados 50 mL da amostra com solução de EDTA dissódico dihidratado 0,012 mol/L, a quente, na presença do indicador negro de Eriocromo-T e de solução tampão de pH 10. O volume consumido do titulante foi igual a 15 mL. A concentração de cálcio, em mg/L, calculada como CaCO3, é igual a
Dados:
Massas Molares (g/mol):
Ca = 40
O = 16
C = 12
O volume, em mL, de ácido nítrico concentrado que deve ser diluído para a preparação de 500 mL de uma solução deste ácido de concentração 0,150 mol/L é igual a
Dados do rótulo do reagente concentrado:
Densidade d = 1,5 g/mL
 = 63% (massa/massa)
= 63% (massa/massa)
Massas molares em g/mol:
H = 1
N = 14
O = 16
Uma amostra de 50 mL de água contendo cátions Fe3+ foi tratada com excesso de NH4OH. O precipitado obtido depois de lavado, secado e calcinado pesou 0,320 g. A quantidade de ferro, em mol/L presente na amostra é
Dados:
Massas molares em g/mol
Fe = 56
O = 16
H = 1
N = 14
Em um procedimento analítico utilizando a técnica de cromatografia gasosa, um determinado analito apresentou um tempo de retenção de 10 minutos e a largura do seu pico na base foi igual a 2 minutos, como mostra o cromatograma na figura abaixo.
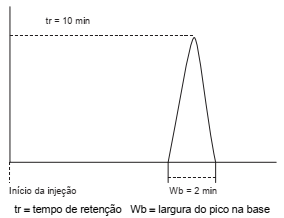
Com base nesses dados para o referido analito, o número de pratos teóricos da coluna é igual a: