Questões de Concurso Público FIOCRUZ 2010 para Tecnologista em Saúde - Proteômica
Foram encontradas 49 questões
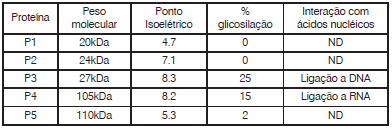
Com base nestes dados o pesquisador optou pela realização dos seguintes passos de purificação: Inicialmente, a mistura foi aplicada em uma coluna de sepharose G50, sendo obtidas, na sequência de eluição, a fração 1 (F1, primeira a ser eluída), e a fração F2. A Fração F2 foi então aplicada em uma coluna de concanavalina. Após a aplicação do tampão de lavagem, foi obtida a fração F3 e, após aplicação do tampão de eluição, obteve-se a fração F4. Submetendo a Fração F3 à uma precipitação em sulfato de amônio, foram então obtidas a fração solúvel (F5) e a fração insolúvel (F6). A aplicação da Fração F1 em uma coluna de Poli-U, seguido da aplicação do tampão de lavagem deu então origem à fração F7 e, após a eluição final, com tampão de eluição, à fração F8.
Com base nas características das proteínas, e nos prodecimentos utilizados pelo pesquisador, assinale a alternativa que melhor identifica as frações nas quais cada uma das proteínas sera isolada de forma purificada.

Com base nestes resultados e nos seus conhecimentos sobre os métodos em questão, observe as afirmativas abaixo, e assinale abaixo a alternativa correta.
I. O método de Folin apresentou uma menor quantificação pois avalia a quantidade de proteínas em função da presença de alguns poucos tipos de aminoácidos que, por serem pouco abundantes na proteína em questão, levou a uma baixa detecção da mesma pelo método.
II. O método de Lowry apresenta diversos tipos de interferência, o que pode ter levado a uma super-estimativa do nível de proteínas presente na fração analisada.
III. O método de Folin, na verdade, não é um método apropriado para a detecção de proteínas, uma vez que avalia a quantidade de açúcares e não de aminoácidos.
IV. O método de Lowry quantifica as ligações peptídicas presentes na proteína avaliada e, desta forma, apresenta uma maior sensibilidade do que o método de Folin que apenas avalia a presença dos aminoácidos tirosina e triptofano.
V. O método de Folin apresenta difícil manipulação e grande variabilidade, o que resulta em uma baixa reprodutibilidade e alta taxa de erro, o que provavelmente resultou em uma sub-estimativa da quantidade de proteínas presentes na amostra.
Assinale:
I. A utilização de detecção por fluorescência aumenta o poder de resolução de proteínas em gel, mas é um método laborioso e que introduz a manipulação de reagentes perigosos, que aumentam o risco de exposição e biossegurança nos laboratórios e que detectam apenas uma fração das proteínas presentes nas amostras.
II. A utilização de marcação radioativa é relevante apenas quando estão sendo realizadas análises proteômicas baseadas em modificações pós-traducionais das proteínas.
III. As técnicas de marcação fluorescente e radioativa aumentam o poder de resolução das análises proteômicas, entretanto requerem etapas anteriores de incubação com compostos apropriados.
Assinale:
I. A faixa de detecção linear dinâmica dos métodos de detecção de proteínas por fluorescência em eletroforeese em gel é normalmente superior aos métodos de coloração tradicional.
II. Corantes de proteínas por fluorescência do tipo SYPRO são fáceis de serem aplicados, por meio de uma única etapa de coloração de 30 a 60 minutos, sem a necessidade de descoloração.
III. Os corantes de flurorescência detectam em geral pequenas quantidades de proteínas (4-8ng) e existem metodologias para sua quantificação através de análises de imagens.
Com relação às afirmativas acima, assinale abaixo a alternativa correta.
Assinale:
I. Na primeira etapa, o polipeptídeo em estudo reage com PITC, que se acopla ao grupo NH2 livre do aminoácido 1.
II. Na segunda etapa, ocorre a hidrólise ácida da proteína conjugada com PITC, que libera a feniltiohidantoína (PTH) do aminoácido 1 e o restante do polipeptídeo, tornando o aminoácido 2 o novo resíduo N-terminal.
III. Na terceira etapa, a análise cromatográfica do PTHaminoácido é realizada.
Assinale: