Questões de Concurso Público SEE-PE 2016 para Professor de Química
Foram encontradas 50 questões
( ) A professora, em uma concepção tradicionalista, mostra o material, pede que os alunos abram o livro-texto e que leiam o capítulo “Água e suas características” para encontrarem as informações de que precisam.
( ) A professora, segundo a concepção tecnicista, apresenta os materiais, mistura o açúcar com a água, mostra o copo aos alunos e conclui que a água se caracteriza com um solvente.
( ) A professora, segundo a concepção interacionista, pede que os alunos misturem o açúcar na água. A seguir, pergunta aos alunos o que eles acham que aconteceu e, ao ouvir de seus alunos que o açúcar “sumiu”, sugere que eles provem a água.
As afirmativas são, respectivamente,
Passados mais quinze dias, continuando a aluna ausente e tendo se esgotado todos os recursos de contatar a família, o dirigente escolar deve
Segundo o documento “Base Curricular Comum para as redes públicas do estado de ensino de Pernambuco”, relacione os paradigmas da Educação na modernidade às respectivas definições.
1. Paradigma do interesse
2. Paradigma da obrigação
3. Paradigma da solidariedade
( ) Propõe a superação do antagonismo disseminado entre o espaço social e o indivíduo na construção de uma sociedade mais justa e democrática.
( ) Funda-se na concepção de que os objetivos pessoais devem ser priorizados sobre os coletivos, daí advindo a noção de indivíduo como uma célula à parte da sociedade e de sociedade como a soma dos indivíduos.
( ) Consagra o culto ao poder centralizador, na medida em que o respeito às regras e aos costumes deve prevalecer sobre a liberdade individual.
Assinale Assinale a opção que indica a sequência correta, de cima para baixo.
Kátia planejou, para as aulas de Geografia, o estudo das Regiões do Brasil por meio de leituras do livro didático, pesquisas e uma prova final. O trabalho em Língua Portuguesa envolverá o estudo de tempos verbais, ortografia, produção de texto e leitura de livros de aventura.
Lúcia estudará com seus alunos o tema “Regiões Brasileiras” e planejou a leitura do livro didático, pesquisas em grupo e trabalhos individuais. Para o trabalho em Língua Portuguesa, selecionou livros que retratam as diferentes regiões brasileiras, além de propor o estudo sobre dialetos e regionalismos do Brasil, a fim de desenvolver a competência oral dos alunos. O planejamento de Língua Portuguesa também inclui o estudo de tempos verbais, ortografia e produção de texto, cujo tema será uma viagem imaginária pelas diferentes regiões do Brasil.
Sobre a abordagem das professoras a respeito das relações entre as disciplinas, assinale a afirmativa correta.
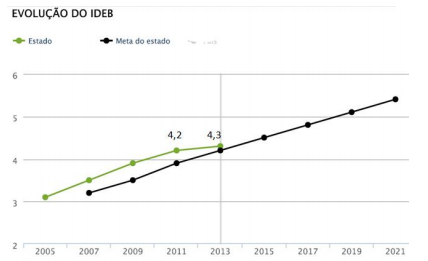
Sobre o IDEB e as informações apresentadas no gráfico, assinale a afirmativa incorreta.
A professora selecionou os livros de literatura a seguir para trabalhar em sua turma do 3º ano.

Tendo em vista que o planejamento curricular de História e
Geografia do 3º ano não previa o estudo sobre a África, a
professora foi questionada sobre o motivo dessa escolha.
Sobre a hipótese apresentada, considerando a legislação educacional vigente, assinale V para a afirmativa verdadeira e F para a falsa.
( ) A legislação considera que o interesse dos alunos é suficiente para a inclusão desse tema no planejamento.
( ) A legislação determina a escolha de um tema relacionado aos direitos humanos.
( ) A legislação obriga o ensino da História e da Cultura Afro-Brasileira no ensino fundamental.
As afirmativas são, respectivamente,