Questões de Concurso Público SEDUC-TO 2023 para Professor da Educação Básica - Professor Regente - Química
Foram encontradas 60 questões
O quadro a seguir mostra as principais fontes antrópicas responsáveis pela liberação de gases estufa na atmosfera, o PAG correspondente e a estimativa de contribuição desse gás.
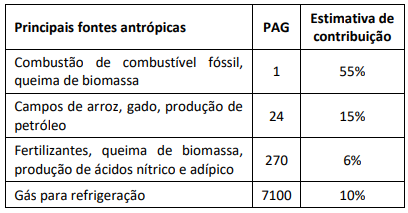
Fonte: ROCHA,J.C. et al. Introdução à Química Ambiental 2ª edição. Porto Alegre: Boookman, 2009. Pg 121
Assinale a opção que apresenta o gás relacionado ao PAG igual a 24.
Leia o texto:
O “sal marinho”, por não passar pelo processo químico do sal comum, tem uma quantidade menor de aditivos químicos como conservantes e corantes associados ao desenvolvimento de câncer. Ele mantém maior quantidade de minerais como cálcio, potássio, ferro, zinco e iodo.
O Globo, 16.3.2023, p.23.
Assinale a opção em que todos os elementos citados formam
naturalmente cátions bivalentes.
Os catalisadores promovem reações
Leia o texto:
“Embora o álcool possa ajudar a adormecer mais rapidamente, já que tem um efeito sedativo, a verdade é a logo prazo a bebida gera um sono de má qualidade, superficial e fragmentado. Isso porque, a bebida alcóolica age sobre o ácido gama-amino butírico, um neurotransmissor que inibe os impulsos entre as células nervosas e promove a calma...”
O Globo, 23.3.2023, p. 19.
A fórmula do neurotransmissor citado no texto é
Dados: E0(Zn2+/ Zn) = – 0,76V E0(Cu2+/ Cu) = + 0,34V
Nessa pilha, formada por zinco e cobre, temos
Considerando que a meia-vida desse radioisótopo é de 13,0 horas, a quantidade que sofreu desintegração, após 2 dias e 4 horas, de uma amostra com 12,00mg de acetato de cobre(II) será, aproximadamente, de
Sobre a posição dos elementos sublinhados na classificação periódica, assinale a opção correta.
O número de moléculas desse gás lançadas por ano na atmosfera é de, aproximadamente,
Dados: Massas molares (g.mol-1 ): H=1; C =12; N=14.
A variação de entalpia da reação apresentada, em kJ, é
Esse alerta tem sido feito pelos Conselhos Regionais de Química frente às informações veiculadas nas mídias digitais. A mistura de água sanitária com vinagre, por exemplo, produz gás cloro que é altamente tóxico.
Os princípios ativos encontrados nos dois produtos citados são
Assinale a opção que indica a concentração de cloreto de sódio nessa água, em ppm.
Assinale a opção que indica apenas moléculas lineares.
Dentre os halogênios, considere o flúor, o cloro, o bromo e o iodo. Sobre esses elementos, analise as afirmativas a seguir.
I. Quanto maior o raio atômico do halogênio, menor a sua energia de ionização. II. O halogênio de maior densidade, entre os citados, é o iodo. III. O cloro é um gás a 25°C e 1 atm.
Está correto o que se afirma em

O gás CO2 de um extintor de incêndio é mais denso do que o ar. À medida que o CO2 sai do extintor, resfria-se significativamente. O vapor d´água no ar é condensado pelo CO2 frio e forma uma nuvem branca.
O fator que faz com que o gás que sai do extintor seja mais denso que o ar é a
Assinale a opção que indica o valor da constante de equilíbrio em função das pressões.
FARIAS,R.F. Introdução à Química Forense. 3ª edição. Campinas, SP: Editora Átomo, 2010. p. 38-39 (adaptado).
Considere o pH 6,0 da urina um valor dentro dos padrões. A urina de um indivíduo que sofre de anorexia, após consumo de anfetamina, pode ter
Considerando o sal comum formado apenas por cloreto de sódio, a quantidade máxima de sal que pode ser utilizada por dia, por pessoa, segundo a OMS é de, aproximadamente,
Dados: massas molares (g.mol-1): Na =23; Cℓ =35,5.
Assinale a opção que indica a reação de obtenção desse polímero, a partir de seu monômero.
Zn (s) + 2MnO2 (aq) + 2NH4+ (aq) → Zn2+ (aq) + Mn2O3 (s) + 2NH3 (g) + H2O (ℓ) Essa pilha não é recarregável e deixa de funcionar quando todo o dióxido de manganês é consumido. Sobre o funcionamento da pilha de Leclanché, analise as afirmativas a seguir.
I. No anodo ocorre a oxidação do zinco, liberando dois elétrons. II. No cátodo ocorre a redução do manganês, liberando dois elétrons. III. No polo negativo, o íon amônio sofre oxidação.
Está correto o que se afirma em
O quadro a seguir apresenta as concentrações de cinco soluções ideais obtidas com diferentes solutos totalmente dissociados.
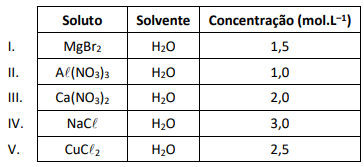
A solução que apresenta a menor pressão de vapor é a