Questões de Concurso Público SEAP-DF 2013 para Professor - Química
Foram encontradas 17 questões
Mn04- + Fe 2+ + H+ —> Mn 2+ + Fe3+ + H20
Quantos mililitros de uma solução 0,0240 mol L-1 são necessários para titular 20,00mL de uma solução 0,112 mol L-1 em Fe2+ .
K (s) + 1/2 Cl2(g)
 KCI(s)
KCI(s)  H = -424,2 kJ/mol
H = -424,2 kJ/molO ciclo de Born-Haber para essa reação é constituído por cinco etapas:
Etapa 1: conversão de K(s)em K(g) ;
Etapa 2: dissociação de 1/2 mol de Cl2(g) em átomos isolados de Cl(g).
Etapa 3: ionização de um mol de átomos de K(g) .
Etapa 4: adição de um mol de elétrons a um mol de átomos isolados de Cl(g).
Etapa 5: combinação de um mol de íons K+(g) e um mol de íons Cl-(g) dando origem à formação de um mol de KCI(s) .
Das etapas acima, são exotérmicas apenas:
SF4 [ SiCl4]2- IF5 [ BCI4 ] -
( I ) ( II ) ( III ) ( IV )
As espécies cujos átomos em negrito utilizam um conjunto de orbitais híbridos sp3d. ao estabelecerem ligações químicas, são:
Dados: B (Z = 5 ) ; F (Z = 9 ) ; Si (Z = 14) ; S (Z = 16 ) ; Cl (Z = 17 ).
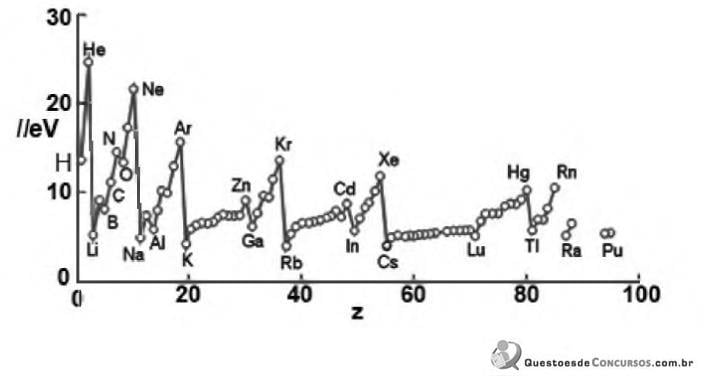
Analisando o gráfico podemos afirmar que:
• Experimento de John Joseph Thomson (1897) (A)
• Experimento com tubo de raios canais Eugen Goldstein (1886) (B)
• Experimento de William Crookes (1858) (C)
• Experimento de Robert Andrews Millikan (1908) (D)
Assinale a alternativa que apresenta a conclusão de cada um dos experimentos (A, B, C, e D)
2 S2O32-
 S4O62- + 2e-
S4O62- + 2e-Para proceder a essa análise, é necessária a utilização dos reagentes a seguir, EXCETO.
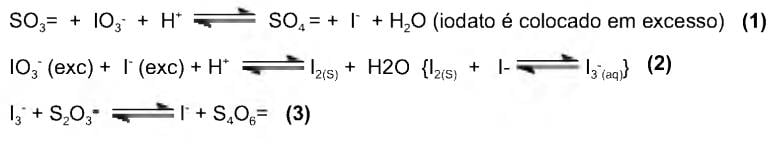
Assinale a alternativa que complete corretamente a lacuna.