Questões de Concurso Público Colégio Pedro II 2015 para Professor - Química
Foram encontradas 30 questões
O ciclo de energia global representado no diagrama mostra a variação de entalpia em diversos processos bioquímicos.
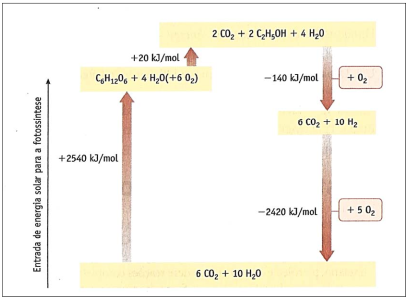
A energia, em kJ, envolvida na produção de um mol de hidrogênio a partir de biomassa é de
Considere a reação do hidroxi‐benzeno com excesso de HOBr. O ácido hipobromoso é obtido por meio da reação:
Br2 + 2 H2O → HOBr + Br– + H3O+ .
Indique a alternativa que apresenta o produto final e o tipo de reação ocorrida entre o hidróxi‐benzeno e o HOBr.
Calcular a ordem de grandeza da concentração de amônia após misturarem‐se 50 mL de uma solução aquosa de amônia 0,01 mol/L com 50 mL de uma solução aquosa de ácido clorídrico a 0,01 mol/L.
(Dado: A constante de acidez do íon amônio é 5,6 X 10–10.)
Uma indústria metalúrgica, para analisar o teor de ferro em uma de suas peças, procedeu da seguinte forma: Pesou uma amostra de 0,6 g desta peça, converteu todo o ferro presente em íons Fe2+(aq) e titulou com uma solução de permanganato de potássio de concentração 0,01 mol.L–1, consumindo 22 mL dessa solução.
Equação iônica: MnO4–(aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + Fe3+(aq) + H2O(l)
Qual o teor de ferro, aproximadamente, em % massa, presente na peça analisada?
A velocidade de desintegração radioativa de um radioisótopo é de primeira ordem em relação ao número de núcleos radioativos. Uma amostra contendo 5 g do 222Rn sofreu desintegração radioativa durante 6,6 dias e teve sua massa reduzida para 1,5 g. Calcule o tempo de meia‐vida, aproximadamente, em dias, desse radioisótopo.
(Dado: ln 0,30 = –1,2.)
A conversão de dióxido de enxofre em trióxido de enxofre é uma das etapas de formação da chuva ácida. Dados termodinâmicos, a 25°C são apresentados na tabela.
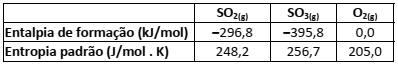
Em relação às características termoquímicas dessa reação, a 25°C, é possível afirmar que
Quando se estudam as diferentes classes de compostos inorgânicos mais comuns, percebe‐se que podem ser obtidas em um laboratório de química sem necessidade de aparatos complexos. Como exemplos, abaixo seguem propostas de algumas reações de obtenção de óxidos, ácidos, bases e sais:
I. Pb(NO3)2(s) 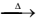 PbO(s) + 2 NO(g) + 1,5 O2(g)
PbO(s) + 2 NO(g) + 1,5 O2(g)
II. CaO(s) + SiO2(S) 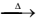 CaSiO3(L)
CaSiO3(L)
III. Cu(s) + H2SO4(conc) → CuSO4(aq) + H2(g)
IV. (NH4)2Cr2O7(s) 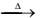 N2(g) + Cr2O3(s) + 4 H2O(L)
N2(g) + Cr2O3(s) + 4 H2O(L)
V. 2 NO2(g) + H2O(L) → HNO3(aq) + HNO2(aq)
VI. Pb(NO3)2(aq) + Fe(s) → não reativa
Das possibilidades de reações químicas apresentadas anteriormente, estão quimicamente corretas, de acordo com os
processos de síntese e reatividade dos compostos inorgânicos, apenas
Brometo de nitrosila é um gás vermelho que pode ser obtido pela reação do óxido nítrico com bromo molecular, de acordo com a seguinte equação química:
NO(g) + ½ Br2(g) → NOBr(g)
Resultados cinéticos da síntese desse gás estão representados na tabela a seguir:
O valor da constante de velocidade da reação de obtenção do brometo de nitrosila, em L2
/mol2 . s, é igual a
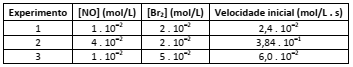
Observe as seguintes reações orgânicas:
Quanto ao tipo de mecanismo e variáveis reacionais, é possível concluir, na ordem dada (I, II e III), que as reações são
Foi realizada uma titulação de 50 mL de uma solução de um diácido fraco de concentração 0,1 mol/L. Como titulante foi utilizada solução de NaOH a 0,1 mol/L. O volume gasto para atingir o ponto de equivalência nessa titulação foi de 50 mL. Escolha, dentre as opções, o indicador (dada a faixa de viragem) menos apropriado para a titulação, considerando um erro de 1%.
(Dados para o diácido: pKa1 = 3 e pKa2 = 8.)
Para o ciclo da glicose interagir com o ciclo de Krebs, há uma reação intermediária na qual a partir de cada molécula de Piruvato produz‐se uma de Acetil‐CoA. Essa etapa é fundamental, principalmente no fígado, que regula a glicemia no sangue, pois é irreversível. O Acetil‐CoA, quando utilizado para produzir energia será oxidado no ciclo de Krebs, formando CO2, água e ATP (trifosfato de adenosina ou adenosina trifosfato). O ATP é um nucleotídeo responsável pelo armazenamento de energia em suas ligações químicas. É constituído por adenosina (um nucleosídeo) associado a três radicais fosfato conectados em cadeia.
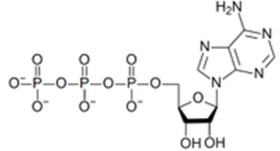
Onde, na molécula de ATP, está amarzenada esssa enegia para consumo no organismo humano?
Determine o pH aproximado de uma solução tampão preparada pela adição de 14,5 g de bicarbonato de sódio e 9 g de carbonato de sódio em água suficiente para completar 500 mL de solução.
(Dados: pKa do ácido é 10,32 ; log 2 = 0,3 ; log1/2 = ‒0,3.)