Questões de Concurso Público IF-MS 2019 para Química
Foram encontradas 25 questões
I. Ano de 1909 – Surgiram as Escolas de Aprendizes e Artífices, por meio do Decreto nº 5.154, de 23 de setembro de 1909, destinadas ao ensino profissional, primário e gratuito. II. Ano de 1941 – Surgiram várias leis que remodelaram o ensino no país, conhecidas como a Reforma Capanema. O ensino profissional passou a ser considerado de nível médio, o ingresso nas escolas industriais passou a depender de exames de admissão e os cursos foram divididos em quatro níveis, correspondentes aos dois ciclos do novo ensino médio. III. Ano de 1942 – As Escolas de Aprendizes e Artífices foram transformadas em Escolas Industriais e Técnicas, por meio do Decreto nº 4.127, de 25 de fevereiro de 1942, e passaram a oferecer a formação profissional em nível equivalente ao do secundário. IV. Ano de 1959 – As Escolas Industriais e Técnicas foram transformadas em autarquias, passando à denominação de Escolas Técnicas Federais, com autonomia didática e de gestão. V. Ano de 1978 – As Escolas Técnicas Federais do Paraná, Minas Gerais e São Paulo foram transformadas em Centros Federais de Educação Tecnológica e receberam mais uma atribuição: formar engenheiros de operação e tecnólogos.
I. As instituições federais de educação superior vinculadas ao Ministério da Educação reservarão, em cada concurso seletivo para ingresso nos cursos de graduação, por curso e turno, no mínimo 30% (trinta por cento) de suas vagas para estudantes que tenham cursado integralmente o fundamental e médio em escolas públicas. II. As instituições federais de ensino técnico de nível médio reservarão, em cada concurso seletivo para ingresso em cada curso, por turno, no mínimo 50% (cinquenta por cento) de suas vagas para estudantes que cursaram integralmente o ensino fundamental em escolas públicas. III. No caso de não preenchimento das vagas reservadas aos autodeclarados pretos, pardos e indígenas e às pessoas com deficiência, aquelas remanescentes serão preenchidas pelos estudantes que tenham cursado integralmente o ensino fundamental ou médio, conforme o caso, em escolas públicas, observadas as reservas realizadas em mesmo nível ou no imediatamente anterior. IV. No prazo de vinte anos, a contar da data de publicação da Lei nº 12.711/2012, será promovida a revisão do programa especial para o acesso às instituições de educação superior de estudantes pretos, pardos e indígenas e de pessoas com deficiência, bem como daqueles que tenham cursado integralmente o ensino médio em escolas públicas. V. Em cada instituição federal de ensino superior, as vagas de que trata a Lei nº 12.711, de 29 de agosto de 2012, serão preenchidas, por curso e turno, por autodeclarados pretos, pardos e indígenas e por pessoas com deficiência, nos termos da legislação, em proporção ao total de vagas no mínimo igual à proporção respectiva de pretos, pardos, indígenas e pessoas com deficiência na população da unidade da Federação onde está instalada a instituição, segundo o último censo da Fundação Instituto Brasileiro de Geografia e Estatística - IBGE.
(COSTA, T.S. et al. Confirmando a esterificação de Fischer por meio dos aromas. Química Nova na Escola, n. 19, p. 36-38, Maio de 2004).
Na esterificação de 1 mol de ácido acético com 1 mol de álcool etílico num recipiente de 1 litro, a 25 °C, o equilíbrio é atingido com constante de equilíbrio igual a 4. Dessa forma, qual a quantidade em mols do éster presente no equilíbrio?
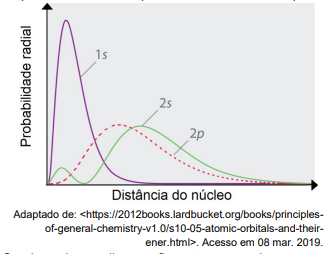
Sendo assim, analise as afirmações a seguir e assinale a alternativa correta:
I. Os orbitais 2s e 2p são degenerados. II. Os orbitais 2s têm uma maior capacidade de penetração do que os orbitais 2p. III. Os orbitais 2p são menos blindados pelos elétrons dos orbitais 1s, quando comparados aos orbitais 2s. IV. Um átomo com configuração eletrônica terminada em ns1 tem menor energia de ionização quando comparado a um outro átomo com configuração eletrônica terminada em ns2np1.
Dados das massas molares em g.mol-1 : C = 12 e O = 16.
Dados: R = 8,31 J.K-1 .mol-1 ; ln 2 = 0,7
SnS + HCℓ + HNO3 → SnCℓ4 + S + NO + H2O
Após o balanceamento da equação, a soma total dos coeficientes mínimos e inteiros das espécies envolvidas na reação é
Para que um átomo de tório com número de massa igual a 228 se desintegre espontaneamente para formar um átomo, do mesmo elemento químico com número de massa igual a 220, os números de partículas alfa e beta que deverão ser emitidas, respectivamente, são:
Reação 1: ΔH1 = +15,3 kJ/mol e ΔS1 =+30 J/K.mol Reação 2: ΔH2 = +1,8 kJ/mol e ΔS2 =-159 J/K.mol.
Escolha a alternativa que representa os valores de ΔG1 e ΔG2 em kJ/mol, respectivamente, e as previsões corretas de espontaneidade ou não espontaneidade da reação nessa temperatura:
(Santos, W.; Mol, G. S. Química cidadã, vol. 1, 2ª ed., São Paulo: Editora AJS, 2013.)
Assinale a alternativa que apresenta, respectivamente, um óxido: básico, ácido, neutro e anfótero:
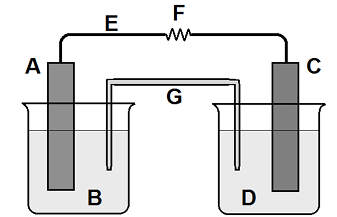
Legenda da figura: (A) placa de estanho, (B) solução aquosa contendo íons Sn2+, (C) placa de alumínio, (D) solução aquosa contendo íons Aℓ3+, (E) fio metálico, (F) resistência elétrica e (G) ponte salina.
Considerando os seguintes dados:
E°(Sn2+/Sn) = -0,14 V E°(Aℓ3+/Aℓ) = -1,68 V
Durante o funcionamento da pilha, o estudante fez algumas afirmações:
I. A concentração de íons alumínio aumenta na solução da direita (D). II. Na placa de alumínio ocorre a corrosão. III. O fluxo de elétrons ocorre pelo fio metálico a partir da placa de estanho em direção à placa de alumínio. IV. Na placa de estanho ocorre a redução. V. A placa de estanho é o polo negativo da cela galvânica.
Dessas afirmações,
Considerando que uma amostra de 2,0 kg, contendo 80% de óxido de cobre II, foi utilizada para reagir com o ácido citado no livro de Stephen King. Admitindo que os outros compostos da amostra não reagem com o ácido, determine a massa aproximada de ácido necessária para que todo o cobre da amostra sofra reação química.
Considere as seguintes massas molares em g.mol-1 : Cu = 63,5; O = 16; H = 1 e S = 32.
Dados: log 2 = 0,30 e log 3 = 0,48
(Atkins, P.W.; Jones, L. Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. Ed 5, Bookman, 2011.)
Sobre titulação, assinale a alternativa correta:
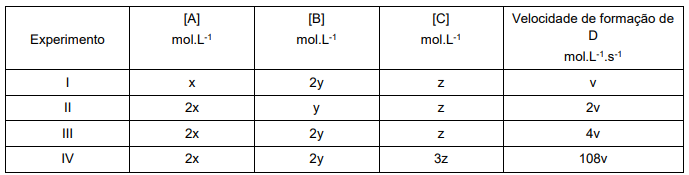
Determine a velocidade da reação em função de v se as concentrações de A, B e C, forem, respectivamente, igual a: 3x, 5y e 2z.
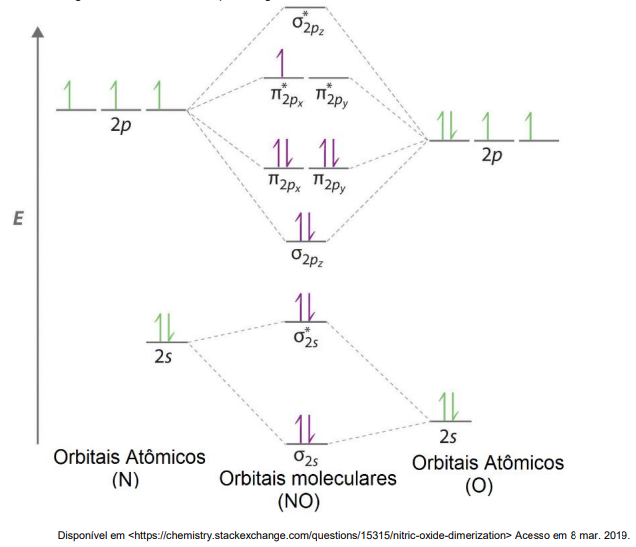
Sendo assim, escolha a alternativa que representa quais características serão apresentadas no íon NO+ .