Questões de Concurso Público IF-MT 2019 para Técnico em Laboratório - Química
Foram encontradas 40 questões
Massas atômicas: Br=79,9; H=1,0; O=16,0
HBrO(l) + H2O(1) ↔ H3O+(aq) + BrO-(aq)
O pH desta solução é:
Pb2+(aq) + 2e- → Pb(s) E°red = - 0,127 V Zn2+(aq) + 2e- → Zn(s) E°red = - 0,762 V Cu2+(aq) + 2e- → Cu(s) E°red = + 0,339 V Mn2+(aq) + 2e- → Mn(s) E°red = - 1,182 V Fe2+(aq) + 2e- → Fe(s) E°red = - 0,409 V
A partir desses dados, assinale a alternativa em que o elemento químico é considerado o melhor agente redutor em reações redox espontâneas.
Ni(s) → Ni2+(aq) + 2e- E°oxi = + 0,236 V Ag(s) → Ag+(aq) + e- E°oxi = - 0,799 V
A partir destes dados, assinale a alternativa que corresponde ao potencial-padrão da célula.
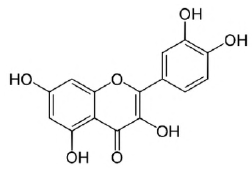
Assinale a alternativa que corresponde aos grupos funcionais presentes na estrutura molecular da quercetina, apresentada abaixo.
Massas atômicas: C=12,0; H=1,0; O=16,0
A diferença na temperatura de ebulição dos compostos descritos é atribuída à:
Assinale a alternativa que indica as substâncias que são consideradas poluentes primários na formação da chuva ácida.
A alternativa que define corretamente a sigla FISPQ é:
I - Água e óleo formam uma mistura heterogênea (líquidos miscíveis), pois uma substância praticamente não se dissolve na outra, podendo ser separadas pelo processo de decantação. II - Quando se coloca uma mistura de água e etanol no congelador, verifica-se que, sob pressão de 1 atm, o congelamento da mistura se inicia a uma temperatura abaixo da temperatura de fusão da água (0 °C). III - Para separar os componentes de uma mistura composta por água, etanol e pedra, podem ser utilizados os processos de filtração comum e destilação simples, respectivamente. IV - Uma mistura eutética se comporta como uma substância pura durante a ebulição, ou seja, apresenta temperatura de ebulição constante. V - A levigação é um método de separação de misturas, em que se utiliza água corrente para carregar os sólidos de baixa densidade, enquanto os mais densos permanecem depositados no fundo do recipiente. É usado pelos garimpeiros para separar o ouro do barro e da areia.
Assinale a alternativa com a sequência CORRETA.
O sulfato de bário, substância muito utilizada em exames radiológicos, pode ser obtido por meio de uma reação entre o ácido sulfúrico e o hidróxido de bário, conforme reação equacionada a seguir:
Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + H2O(l)
Considerando que a reação tem um rendimento de 80%, a massa, em gramas, de sulfato de bário obtido, quando são utilizados 0,05 kg de hidróxido de bário, será aproximadamente de:
Massas atômicas: H = 1; Ba = 137; S = 32; O = 16.
C3H8 (g) + O2 (g) → CO2 (g) + H2O (l)
Considerando os dados apresentados na tabela a seguir, o calor de combustão (ΔH) de 0,5 mol de propano será:
Composto ΔHf° (kJ mol-1) C3H8 - 103,8 CO2 - 393,5 H2O - 285,8 Fonte: Novais (2016).
( ) O elemento em questão é um metal alcalino. ( ) Faz ligação iônica, transformando-se em um cátion X+2. ( ) Quando se combina com um elemento Y da família dos halogênios, apresenta a fórmula X2Y. ( ) Está situado no quinto período da tabela periódica e apresenta menor energia de ionização que o elemento flúor. ( ) É um metal de transição externa.
Marque a alternativa com a sequência CORRETA:
Massas atômicas: H = 1; N = 14; O = 16.
O metano tem sido empregado em várias reações, como na obtenção do gás hidrogênio, conforme equação a seguir:
CH4 (g) + H2O (g) ⇋ CO (g) + H2 (g)
Em um recipiente de 2 litros foram adicionados 4 mol de metano e 5 mol de água. Depois de certo tempo, a reação atingiu o equilíbrio e foram produzidos 6 mol de gás hidrogênio. A constante de equilíbrio (Kc) obtida será aproximadamente de:
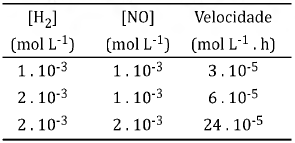
A seguir são apresentados dados experimentais de uma reação de obtenção do gás hidrogênio.
2 H2(g) + 2 NO(g) → 1 N2(g) + 2 H2O (l)
 Fonte: Canto (1998).
Fonte: Canto (1998).
Baseado nos dados experimentais apresentados na tabela, marque a alternativa que apresenta a ordem da reação em relação a H2 e NO, respectivamente.