Questões de Concurso Público SEED-PR 2022 para Área de Conhecimento: Química
Foram encontradas 40 questões
I. Os elementos em um grupo da tabela têm propriedades similares porque apresentam o mesmo tipo de organização dos elétrons na periferia dos átomos. II. Todos os metais, com exceção do mercúrio, são sólidos à temperatura ambiente. III. Enxofre, fósforo, selênio e telúrio são elementos não-metálicos.
Está correto o que se afirma em
I. Quando o sulfeto de chumbo e o óxido de chumbo são aquecidos juntos, os produtos são chumbo metálico e dióxido de enxofre. Se 14 g de óxido de chumbo reagem, forma-se 9,42 x 10-2 mol de átomos de chumbo. II. O mais importante processo comercial para converter N2 do ar em compostos contendo nitrogênio é baseado na reação de N2 e H2 para formar NH3. São formadas 4 mols de NH3 a partir de 3 mols de N2 e 6 mols de H2. III. Xileno é uma substância composta somente de carbono e hidrogênio. Uma amostra de xileno foi queimada em excesso de oxigênio e este produziu somente como produtos 33,4 g de CO2 e 8,55 g de água. A fórmula empírica do xileno é C4H5.
Está correto o que se afirma em
I. Existem 2,53 x 1024 átomos de H em 0,350 mol de C6H12O6. II. Em uma molécula de tetracloreto de carbono existem 1,02 x 10-22 g. III. São produzidas 0,3 g de água na oxidação de 1 g de glicose – C6H12O6.
Está correto o que se afirma apenas em
( ) A radiação gama consiste em fótons de alta energia e não muda o número atômico nem a massa atômica de um núcleo. ( ) Quanto menor a energia de coesão, mais estável é o núcleo no sentido da decomposição. ( ) Os núcleos 2He4 , 20Ca40 e 43Tc98 exibem estabilidade. ( ) O produto formado quando o rádio-226 sofre decaimento alfa é 86 Rn222 .
A sequência está correta em
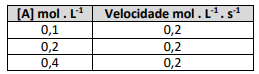
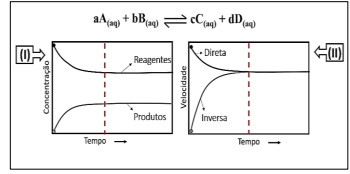
A partir das informações, a Lei de Velocidade para esta reação será de:
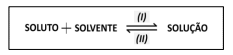
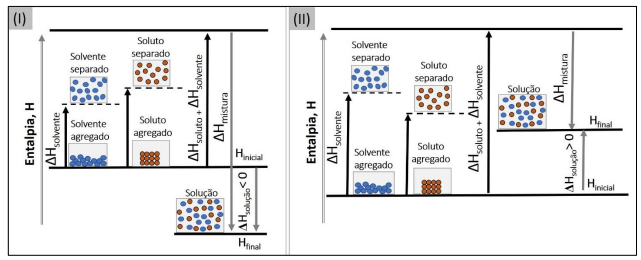
Dados: NaCl ΔHsolução= 3,9 kJ.mol-1 ; MgSO4 ΔHsolução= –91,2 kJ.mol-1 ; NH4NO3 ΔHsolução= 26,4 kJ.mol-1 .
Considerando a imagem, os dados fornecidos e os conceitos relacionados ao tema, assinale a afirmativa correta.
N2(g) + H2(g) ⇌ NH3(g)
Considerando, ainda, as propriedades do equilíbrio químico citado, assinale a afirmativa correta.
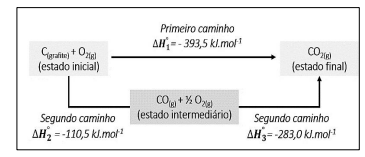
Considerando o diagrama e os conceitos termodinâmicos de uma forma geral, assinale a afirmativa correta.
A imagem mostra as forças relativas de agentes oxidantes e redutores; observe.
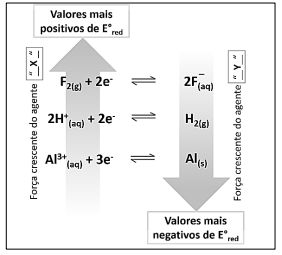
Sobre o tema e o disposto na imagem, assinale a afirmativa
correta.
A ferrugem é um processo conhecido e que implica em significativo impacto econômico.
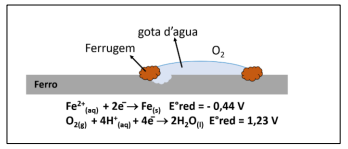
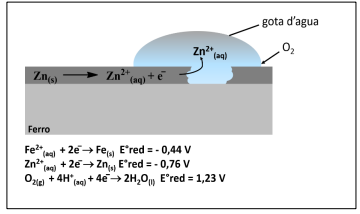
Considerando os conceitos químicos vinculados à formação da
ferrugem e a imagem apresentada, assinale a afirmativa correta.
Observe atentamente as equações químicas a seguir:
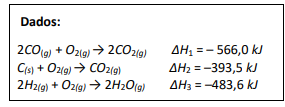
Equação global: C(s) + H2O(g) → CO(g) + H2(g) ΔH4 =_____ kJ
Considerando os conceitos termoquímicos e os dados fornecidos, assinale a afirmativa correta.