Questões de Concurso Público IF-SE 2024 para Professor EBTT - Química (Química Analítica)
Foram encontradas 30 questões
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577142
Química
As tetraciclinas são uma classe de antibióticos de amplo
espectro eficaz contra doenças infecciosas causadas por
bactérias gram-positivas, gram-negativas e por alguns
protozoários. A doxiciclina é um antibiótico da classe das
tetraciclinas amplamente utilizado em medicina veterinária
especialmente no controle de infeção em rebanhos.
Observe a representação a seguir.
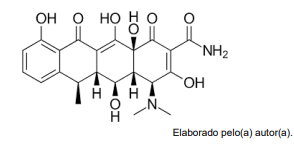
Os grupos funcionais orgânicos presentes na estrutura da doxiciclina mostrada na figura são:

Os grupos funcionais orgânicos presentes na estrutura da doxiciclina mostrada na figura são:
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577143
Química
A calcita (CaCO3) é um dos minerais mais abundantes na
crosta terrestre, formada a partir da precipitação do
carbonato de cálcio em ambientes aquáticos. Este mineral é
muito importante como formador de rocha, ocorrendo em
sedimentos e em rochas ígneas, metamórficas e
sedimentares. Também apresenta centenas de usos na
indústria, como na fabricação do cimento, como carga
mineral em cosméticos, tintas e borrachas, na siderurgia, na
metalurgia, na agricultura e muitas outras.
Calcule a variação da entalpia (ΔH) para a reação global de formação de 0,325 ton calcita a partir de seus elementos constituintes utilizando as reações e os dados termodinâmicos fornecidos a seguir.
Use: Massa molar O = 16 g.mol-1,
I) C(s) + O2(g) ➔ CO2(g) ∆ H = -393,5 kJ mol-1
II) CaO(s) ➔ Ca(s) + 1/2O2(g) ∆H = +635,0 kJ mol-1
III) CaO(s) + CO2(g) ➔ CaCO3(s) ∆H = -178,3 kJ mol-1
Calcule a variação da entalpia (ΔH) para a reação global de formação de 0,325 ton calcita a partir de seus elementos constituintes utilizando as reações e os dados termodinâmicos fornecidos a seguir.
Use: Massa molar O = 16 g.mol-1,
I) C(s) + O2(g) ➔ CO2(g) ∆ H = -393,5 kJ mol-1
II) CaO(s) ➔ Ca(s) + 1/2O2(g) ∆H = +635,0 kJ mol-1
III) CaO(s) + CO2(g) ➔ CaCO3(s) ∆H = -178,3 kJ mol-1
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577144
Química
A velocidade das reações químicas pode ser alterada
modificando-se parâmetros experimentais como
temperatura do meio reacional, concentração dos
reagentes, uso de catalisadores e outros. Em um
experimento didático foi estudada a influência da
concentração dos reagentes em uma reação química, onde
foram obtidos os dados mostrados na tabela a seguir.
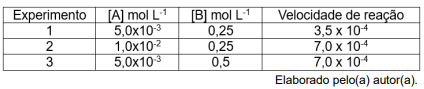
De acordo com os dados apresentados, a lei de velocidade para a reação estudada é:

De acordo com os dados apresentados, a lei de velocidade para a reação estudada é:
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577145
Química
O biodiesel é produzido a partir de óleos vegetais ou
gorduras animais através de um processo químico no qual
triacilglicerídeos reagem com um álcool, geralmente
metanol ou etanol, na presença de um catalisador. Esse
processo resulta na formação de ésteres metílicos ou
etílicos de ácidos graxos, que constituem o biodiesel, e
glicerol como subproduto. O nome da reação da síntese do
biodiesel é
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577146
Química
O modelo de repulsão dos pares de elétrons de valência
(VSEPR) amplia a teoria da ligação química de Lewis
incluindo regras para explicar as diferentes formas das
moléculas e seus ângulos de ligação. Utilizando o modelo
VSEPR, prediga respectivamente, a geometria molecular e
a forma de arranjo de elétrons para a moléculas de NF3.
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577147
Química
É sabido que o equilíbrio em fase gasosa mostrado abaixo
é um processo altamente endotérmico.
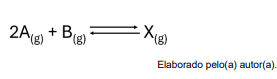
Segundo o principío de Le Chatelier, a alteração no sistema que deve ser feita para que equilíbrio favoreça a formação de reagentes é
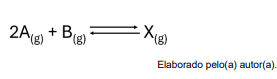
Segundo o principío de Le Chatelier, a alteração no sistema que deve ser feita para que equilíbrio favoreça a formação de reagentes é
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577148
Química
Uma célula à combustível pode ser definida como um
dispositivo eletroquímico que converte a energia química de
um combustível em energia elétrica através de reações de
oxidação e redução. Este modelo de geração de energia tem
ganhado espaço por apresentar algumas vantagens em
relação à queima de combustíveis fósseis, como emissão
praticamente nula de gases de efeito estufa, operação
silenciosa devido à ausência de engrenagens.
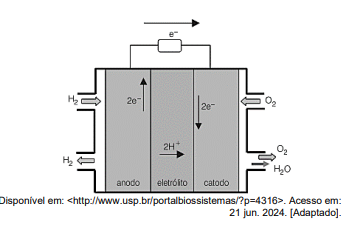
A figura acima mostra o esquema de funcionamento de uma célula operando com H2 como combustível. Analisando o esquema, durante funcionamento deste dispositivo,

A figura acima mostra o esquema de funcionamento de uma célula operando com H2 como combustível. Analisando o esquema, durante funcionamento deste dispositivo,
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577149
Química
O 1-ciclohexanol foi submetido a reação de oxidação na
presença de um catalisador metálico, produzindo como
único produto a 1-ciclohexanona. Em seguida, o produto foi
caracterizado por espectroscopia de absorção no
infravermelho, que exibiu uma um pico intenso na faixa de
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577150
Química
A teoria da ligação de Valência explica por que uma ligação
dupla carbono-carbono é mais forte do que uma ligação
simples carbono-carbono, porém mais fraca do que a soma
de duas ligações simples. Este efeito nas forças da ligação
carbono-carbono pode ser fundamentado por:
Ano: 2024
Banca:
IV - UFG
Órgão:
IF-SE
Prova:
IV - UFG - 2024 - IF-SE - Professor EBTT - Química (Química Analítica) |
Q2577151
Química
Um grupo de pesquisa está estudando como a temperatura
afeta a energia de ativação da reação de síntese de metanol
a partir da fermentação de açúcares mediada leveduras
geneticamente modificadas. Os dados preliminares deste
estudo indicam que na temperatura de 40°C a reação de
fermentação apresenta constante de velocidade k1. Quando
a temperatura do meio chega a 60°C, a constante de
velocidade de formação de metanol dobra. Calcule a
energia de ativação para a reação de síntese de metanol
mencionada acima.
Use: R = 8,314 J mol-1 K-1 ; ln2 = 0,693
Use: R = 8,314 J mol-1 K-1 ; ln2 = 0,693