Questões de Concurso Público UFPR 2024 para Químico
Foram encontradas 40 questões
–d[A] / dt = –d[B] / dt = d[C] / dt = d[D] / dt = k[A]a . [B]b
Com relação à ordem da reação (a, b e a + b), assinale a alternativa correta
ER║HA, CA│Pt, H2 (1 atm)
Dados:
ΔE = Ec – Ea
Ka = [H3O+] . [A–] / [HA]
E = E0 – (0,0592 / n). log ([Red.] / [Oxid.]), em que “Red.” é a espécie reduzida, e “Oxid.”, a oxidada.
Com relação ao exposto, assinale a alternativa que expressa corretamente a relação entre Ka e ΔE.
NH4 + + HNO2 → N2 + 2 H2O + H+
Cujo mecanismo é:
NH4 + → NH3 + H+ (Rápida) HNO2 → H2O + NO+ (Rápida) NO+ + NH3 → NH3NO+ (Lenta) NH3NO+ → N2 + H2O + H+ (Rápida)
Com relação ao exposto, assinale a alternativa que apresenta corretamente a expressão da lei da velocidade diferencial para a reação do HNO2 com NH4 +.
HInd + H2O → H3O+ + Ind– Ki = [HInd] / [H3O+] . [Ind–]
Sabe-se que o olho humano consegue identificar a mudança de cor quando:
[HInd] = 10[Ind–] cor A [Ind–] = 10[Hind] cor B
Assinale a alternativa que apresenta corretamente o intervalo de pH em que ocorre a mudança de cor de um indicador, cuja Ki = 10-7.
CCl4 → CHCl3 –1,0 V (vs ECS)
CHCl3 → CH4 –1,8 V (vs ECS)
Hg(l) → Hg2Cl2(s)
Em relação ao exposto, assinale a alternativa que apresenta corretamente o número de elétrons necessário para a redução de CCl4 a CH4.
C10H8 + O2 → CO2 + H2O
Considerando que uma massa m de naftaleno foi queimada em uma bomba calorimétrica (V constante) de capacidade calorífica Cc, (J/°C), indicando uma variação de temperatura Δt (°C), e que os gases são ideais e o volume dos sólidos e líquidos é desprezível, assinale a alternativa que apresenta corretamente a expressão da variação de entalpia de combustão (ΔH) do naftaleno.
Dados: MM (naftaleno) = 128 g/mol; P = pressão (kPa); V = volume (L); R = constante universal dos gases perfeitos (J/mol.K); T = temperatura absoluta (K); e ΔH = ΔU + (PV), em que ΔU é a variação da energia interna do sistema (J).
5 Hg0 + 2 MnO4 – +16 H+ → 5 Hg+2 + 2 Mn+2 + 8 H2O
6 MnO4 – + 5 NH2OH + 13 H+ → 6 Mn+2 + 5 NO3 – + 14 H2O
Hg+2 + SnCl2 + 2 Cl – → Hg0 + SnCl4
Com relação ao procedimento descrito, é correto afirmar:
pH = pKa + log([OAc–] / [HOAC])
Com relação a esse exemplo, assinale a alternativa correta.
Na cromatoplaca, em ordem decrescente do Rf, observam-se os seguintes compostos, em sequência:
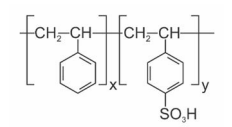
Considerando que a titulação de amostras de 150,00 mg de PS-SPS consumiu, em média, 20,00 mL da solução titulante, assinale o valor que mais se aproxima do grau de sulfonação do PS-SPS, expresso em mol%.
RMN de 1H (400 MHz, CDCl3, TMS), δ (ppm): 4,12 (q, J = 7,1 Hz, 2H); 2,04 (s, 3H); 1,26 (t, J = 7,1 Hz, 3H).
O espectro de RMN de 1H descrito corresponde ao composto:
1. A pureza óptica da mistura citada é de 20%.
2. Os dois isômeros apresentam o mesmo valor de ponto de ebulição.
3. A mistura analisada é uma mistura racêmica.
4. Os dois componentes da mistura apresentada não podem ser separados.
Assinale a alternativa correta.
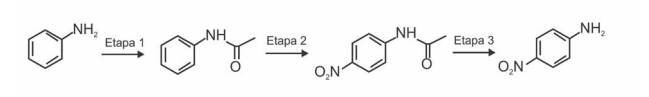
1. A acetanilida pode ser obtida por reação de anilina com cloreto de acetila.
2. A reação da Etapa 2 é uma reação de substituição nucleofílica.
3. A p-nitroanilina pode ser transformada em p-nitrofenol.
4. A acetanilida possui um anel aromático desativado para SEAr.
Assinale a alternativa correta.


Dados do procedimento experimental da literatura: 10,00 g de p-nitroacetanilida; 50,00 mL de solução aquosa de ácido sulfúrico 50% (V/V); solução aquosa de hidróxido de sódio 20% (m/V).
Outras informações: ácido sulfúrico concentrado: densidade = 1,84 g/cm3; massas atômicas aproximadas (g/mol): C = 12,00; H = 1,00; N = 14,00; O = 16,00; Na = 23,00; S = 32,06.
Considerando que a pureza do hidróxido de sódio seja de 90% (m/m), a quantidade de NaOH(s), em gramas, necessária para atender a demanda dessa aula experimental é de: