A etapa de hidrólise ácida da p-nitroacetanilida (Etapa 3) é...
Próximas questões
Com base no mesmo assunto
Q2568820
Química
Texto associado
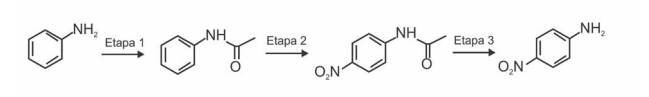
A síntese de p-nitroanilina é um experimento clássico em disciplinas de Química Orgânica Experimental, pois essa rota permite a
abordagem de inúmeros tópicos dos Programas de Química Orgânica adotados por várias instituições de ensino superior. A figura a
seguir apresenta, esquematicamente e de forma resumida, uma rota sintética para a obtenção de para-nitroanilina a partir da anilina.

A etapa de hidrólise ácida da p-nitroacetanilida (Etapa 3) é composta também da adição sequencial de uma solução
de base forte para isolamento da p-nitroanilina. Em uma aula experimental, serão realizados 6 experimentos, em
paralelo, cada um partindo de 5,00 g de p-nitroacetanilida. O procedimento orienta a adição de um volume de solução
aquosa de NaOH, calculado de modo a reagir completamente com a quantidade de ácido adicionada, seguida do ajuste
até um pH levemente alcalino. A solução de NaOH, por sua vez, precisa ser previamente preparada em quantidade
suficiente não só para atender à quantidade calculada pela turma, mas também para gerar um excedente de 50%.
Dados do procedimento experimental da literatura: 10,00 g de p-nitroacetanilida; 50,00 mL de solução aquosa de ácido sulfúrico 50% (V/V); solução aquosa de hidróxido de sódio 20% (m/V).
Outras informações: ácido sulfúrico concentrado: densidade = 1,84 g/cm3; massas atômicas aproximadas (g/mol): C = 12,00; H = 1,00; N = 14,00; O = 16,00; Na = 23,00; S = 32,06.
Considerando que a pureza do hidróxido de sódio seja de 90% (m/m), a quantidade de NaOH(s), em gramas, necessária para atender a demanda dessa aula experimental é de:
Dados do procedimento experimental da literatura: 10,00 g de p-nitroacetanilida; 50,00 mL de solução aquosa de ácido sulfúrico 50% (V/V); solução aquosa de hidróxido de sódio 20% (m/V).
Outras informações: ácido sulfúrico concentrado: densidade = 1,84 g/cm3; massas atômicas aproximadas (g/mol): C = 12,00; H = 1,00; N = 14,00; O = 16,00; Na = 23,00; S = 32,06.
Considerando que a pureza do hidróxido de sódio seja de 90% (m/m), a quantidade de NaOH(s), em gramas, necessária para atender a demanda dessa aula experimental é de: