Questões de Concurso Público UFES 2015 para Técnico de Laboratório - Química
Foram encontradas 60 questões
A tabela a seguir fornece os valores de pH ou pOH de soluções.

Arespeito da concentração molar de íons hidrogênio [H+] presente nas soluções, é CORRETO afirmar:
Cr2O72-(aq) + 6Fe2+(aq) + 14H+(aq) -› 2Cr3+(aq) + 6Fe3+(aq) + 7H2O(l)
Considerando a estequiometria dessa reação, a porcentagem em massa de Fe na amostra analisada é, aproximadamente, igual a

Com base nos dados tabelados, são considerados “eletrodos de sacrifício” adequados as barras de
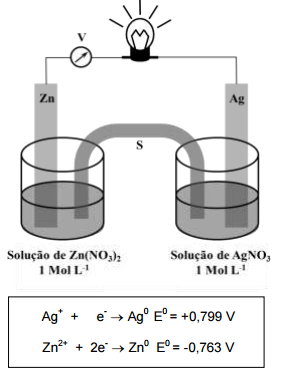
Considerando a célula eletroquímica e os potenciais-padrão de redução acima representados, é CORRETO afirmar:
SO2(g) + ½O2(g) ⇋ SO3(g)
A expressão da constante de equilíbrio KC, com base na lei de ação das massas, para esta reação é
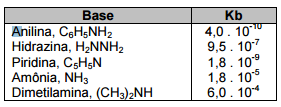
Analisando esses valores, é CORRETO afirmar:
I. A absorbância (A) de uma solução está relacionada com a transmitância de forma logarítmica, A=-log T. II. A absorbância é diretamente proporcional à concentração de uma espécie absorvente (c) e ao caminho óptico (b) do meio absorvente, A=εbc III. A constante de proporcionalidade chamada absortividade molar, à qual é dado o símbolo especial ε, é independente da natureza da espécie analisada. IV. Se a concentração é expressa em mols por litro e o caminho óptico em centímetros, então o coeficiente de absortividade molar possui as unidades de L mol-1cm-1.
Estão corretas APENAS as afirmativas
I. O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio. II. A potenciometria é uma técnica eletroanalítica em que se obtêm medidas de potencial geradas por espécies químicas em um meio, sem a necessidade da utilização de um eletrodo de referência. III. A medida do potencial de um eletrodo indicador pode ser utilizada para determinar o ponto de equivalência de uma titulação.
É CORRETO

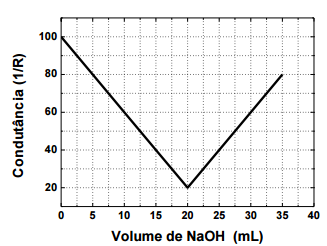
Considerando as medidas de condutância que poderiam ser obtidas para essas soluções, é CORRETO afirmar:
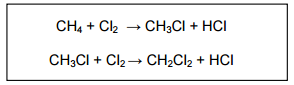
As reações mostradas acima para a obtenção de diclorometano são de
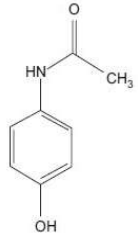
Os grupos funcionais presentes no paracetamol são: