Questões de Concurso Público UFES 2015 para Técnico de Laboratório - Química
Foram encontradas 60 questões
I. Classificar Dados. Exemplo: selecione as colunas A e B, clique no menu “Dados", em seguida na opção “Classificar" e, finalmente, clique OK.
II. Autofiltro. Exemplo: selecione as colunas A e B, clique no menu “Dados", em seguida abra o submenu “Filtro" e clique na opção “Autofiltro".
III. Filtragem. Exemplo: após criação do Autofiltro, clique sobre o botão que aparece no canto inferior direito da célula B1, desmarque o valor “Masculino" e clique em OK.
IV. Ocultar Linhas. Exemplo: para as linhas 3, 5, 7 e 9, uma de cada vez, posicione o ponteiro do mouse sobre a junção do cabeçalho da linha com a linha seguinte, clique e arraste para diminuir sua altura, soltando assim que a mensagem “Ocultar" for exibida.
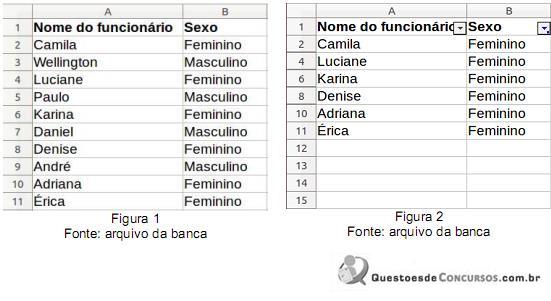
Dentre os recursos e exemplos descritos anteriormente, os que precisam ser usados para, a partir da figura 1, ter como resultado a figura 2, acima, são
I. Na hipótese de atos de improbidade administrativa que atentam contra os princípios da Administração Pública, as penas serão ressarcimento integral do dano, se houver, perda da função pública, suspensão dos direitos políticos de três a cinco anos, pagamento de multa civil de até cem vezes o valor da remuneração percebida pelo agente e proibição de contratar com o Poder Público ou receber benefícios ou incentivos fiscais ou creditícios, direta ou indiretamente, ainda que por intermédio de pessoa jurídica da qual seja sócio majoritário, pelo prazo de três anos.
II. Na hipótese de atos de improbidade administrativa que causam prejuízo ao Erário, as penas serão ressarcimento integral do dano, perda dos bens ou valores acrescidos ilicitamente ao patrimônio, se concorrer essa circunstância, perda da função pública, suspensão dos direitos políticos de cinco a oito anos, pagamento de multa civil de até duas vezes o valor do dano e proibição de contratar com o Poder Público ou receber benefícios ou incentivos fiscais ou creditícios, direta ou indiretamente, ainda que por intermédio de pessoa jurídica da qual seja sócio majoritário, pelo prazo de cinco anos.
III. Na hipótese de atos de improbidade administrativa que importam enriquecimento ilícito, as perdas serão perda dos bens ou valores acrescidos ilicitamente ao patrimônio, ressarcimento integral do dano, quando houver, perda da função pública, suspensão dos direitos políticos de oito a dez anos, pagamento de multa civil de até três vezes o valor do acréscimo patrimonial e proibição de contratar com o Poder Público ou receber benefícios ou incentivos fiscais ou creditícios, direta ou indiretamente, ainda que por intermédio de pessoa jurídica da qual seja sócio majoritário, pelo prazo de dez anos.
São CORRETAS as proposições
A reação de 1 mol de grafita, C(s), com 1 mol de oxigênio gasoso produz 1 mol de dióxido de carbono gasoso. O diagrama abaixo mostra a variação de entalpia para essa reação.
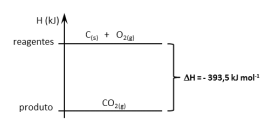
Analise as afirmativas abaixo sobre essa reação.
I. A energia liberada pode ser chamada de entalpia de formação de CO2(g).
II. A energia liberada pode ser chamada de entalpia de combustão de grafita.
III. É uma reação endotérmica.
IV. Para queimar 1 mol de C(s), é necessário fornecer 393,5 kJ para o sistema.
Está(ão) CORRETA(S):
Na reação de zinco metálico (Zn(s)) com ácido clorídrico (HCl(aq)), há formação de cloreto de
zinco (ZnCl2(aq)) e gás hidrogênio (H2(g)), conforme a seguinte equação:
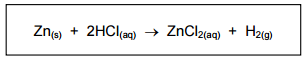
Nessa reação, o HCl é consumido e a tabela a seguir mostra a sua concentração em função do tempo.
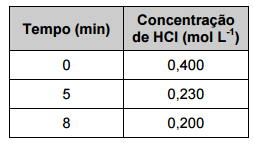
A alternativa que apresenta o valor correto da velocidade média da reação (mol L-1 min-1
) no intervalo de 5 a
8 minutos é
A Figura abaixo mostra um diagrama de fases de uma substância pura.
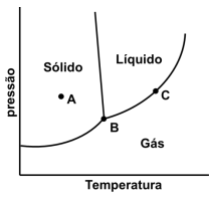
O número de fases que estão presentes em cada um dos pontos circulares identificados como A, B e C,
respectivamente, nessa figura, é
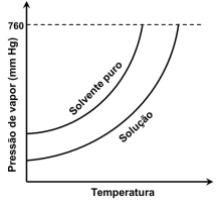
A partir do gráfico, é CORRETO afirmar:
O volume, em litros (L), de uma solução de H2SO4 1,0 mol L-1 que reage com 0,5 mol de NaOH é:
Analise as reações abaixo.
I. SO2 + H2O2 -› H2SO4
II. SO2 + H2O -› H2SO3
III. SO2 + NH4OH -› NH4HSO3
Das reações, ocorre o fenômeno de oxirredução em