Questões de Concurso Público UFMG 2018 para Químico II
Foram encontradas 30 questões
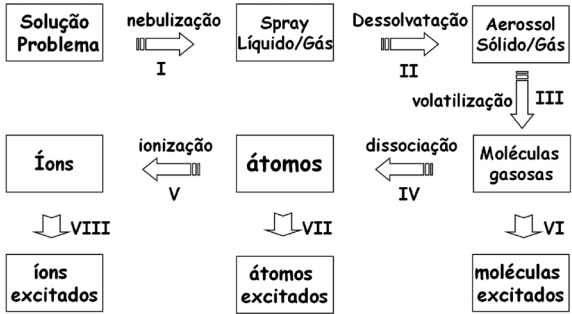
Considere o esquema e as seguintes afirmações:
I – A etapa IV é a responsável por produzir os átomos gasosos no estado fundamental. II – Na absorção atômica, utiliza-se um modulador, após a lâmpada, para eliminar os problemas que podem ser causados pela etapa VII. III – Somente a etapa V diminui a população de átomos gasosos no estado fundamental. IV – A etapa VII é indesejável para a absorção atômica, por diminuir a população de átomos gasosos no estado fundamental, porém é uma etapa essencial da espectrometria de emissão atômica.
Em relação a essas afirmativas, estão CORRETAS
NaOH sólido; ácido acético (HAc) 2,00 mol L-1 (pKa = 4,74); ácido fosfórico (H3PO4) 2,00 mol L-1 (pKa1 = 2,23; pKa2 = 7,21; pKa3 = 12,32); amônia (NH3) 1,00 mol L-1 (pKa = 9,25); KH2PO4 sólido.
A mistura de quais dos reagentes acima, nas proporções adequadas, possibilita a preparação do tampão de pH 7,5, com boa capacidade de resistir às alterações de pH?
Com relação à interferência de ionização é CORRETO afirmar que
I - o supressor de ionização é um sal que contém um metal facilmente ionizável, que, ao se ionizar reduz a temperatura da chama, impedindo a ionização do analito. II - a supressão da ionização se dá pelo deslocamento de equilíbrio gerado pelo aumento da pressão parcial de elétrons na chama, após a ionização do supressor. III - a interferência de ionização é multiplicativa. Quando observada em uma curva de calibração, acarreta um coeficiente angular mais baixo, do que o obtido após a adição do supressor de ionização. IV - os elementos de fácil ionização, como os metais alcalinos, podem apresentar essa interferência, mesmo em chamas de acetileno/ar.
Em relação a essas afirmativas, estão CORRETAS:
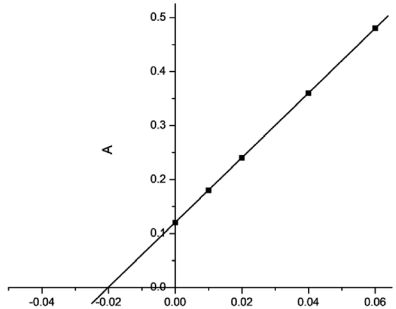 CPb adicionada (mg/L)
CPb adicionada (mg/L) Com base nos resultados, o teor de chumbo da amostra de tequila analisada é:
IO3 – + I– + H+ ⇆ I2 + H2 O (produção de iodo) I2 + S2 O3 2– ⇆ S4 O6 2– + I– (titulação do iodo formado)
Para a resolução desta questão, estas equações deverão ser balanceadas. Nesse processo, cada milimol de iodato, após adicionada a solução de iodeto, consumirá
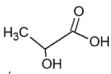
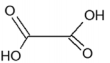
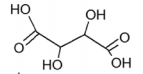
Ácido lático Ácido oxálico Ácido tartárico pKa = 3,85 pKa1= 1,25 ; pKa2 = 4,29 pKa1=3,04; pKa2=4,37
Em relação a esses ácidos, é CORRETO afirmar que