Questões de Concurso Público UFPA 2017 para Químico
Foram encontradas 27 questões
A figura abaixo esquematiza um laboratório no qual uma balança analítica deve ser instalada.
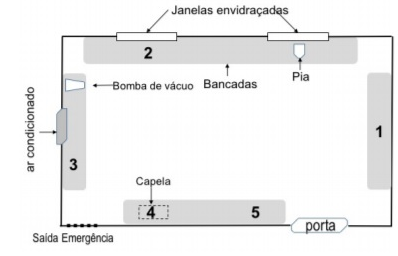
Dentre as posições de 1 a 5 assinaladas, a posição adequada neste caso é a posição
É comum encontrar, em laboratórios, pipetas volumétricas que apresentam na parte superior uma marcação com um traço ou com dois traços, conforme representado na figura abaixo.
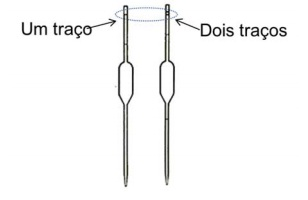
Esses traços indicam que
Dentre os cinco pictogramas relacionados à classificação de risco de reagentes químicos abaixo representados, o que se refere a um reagente oxidante é o de número.

A determinação de cromo em água pode ser feita colorimetricamente, complexando o cromo com difenilcarbazida. A absortividade molar, a 540 nm, desse complexo é de 41.700 L mol-1 cm-1. Uma amostra de água foi analisada por esse método em uma cela de caminho ótico de 5 cm e obteve-se uma absorbância de 0,4. Assim, a concentração aproximada, em ppm, de cromo na solução é de
DADO:
Massa Molar Cromo (g mol-1) = 52
Cada curva na figura abaixo representa a mobilidade efetiva de uma espécie química em função do pH, utilizada para se determinar as condições de separação dessas espécies por eletroforese.
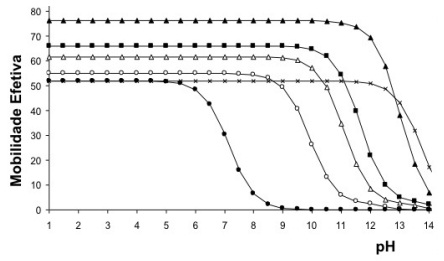
Fonte: PIOVEZAN, Marcel. Desenvolvimento de Metodologias por Eletroforese Capilar para Avaliação de Parâmetros Químicos da Qualidade de Biodiesel, 2010.70 f. Dissertação (Mestrado em Química) – PPGQ-UFSC, Florianópolis - SC. Adaptado.
Assim, o pH que deve ser utilizado para a separação de tais espécies por este experimento de eletroforese
deve ser
A figura abaixo esquematiza um cromatograma obtido por CLAE.
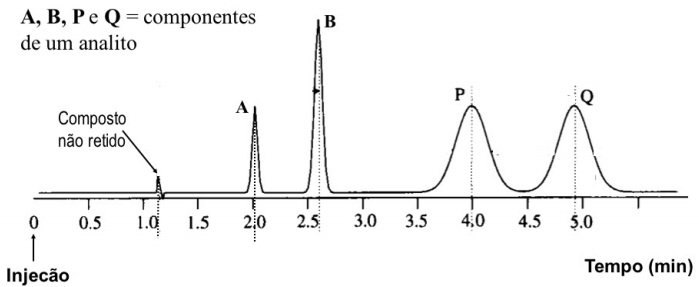
Pela análise desse cromatograma, conclui-se que
Abaixo estão listados cinco compostos:
1. Sílica gel
2. Alumina
3. Terra diatomácea
4. Poliamida
5. Celulose
Dentre esses compostos, pode(m) ser utilizado(s) como adsorvente(s) para cromatografia em camada delgada
Em relação aos solventes (ou misturas deles) utilizados em cromatografia de camada delgada, são feitas algumas afirmações de caráter geral.
1. Aumentar a força eluente do solvente tende a diminuir a separação entre os componentes de uma amostra e aumentar Rf.
2. Diminuir a força eluente do solvente tende a aumentar a separação entre os componentes de uma amostra e diminuir Rf.
3. Se uma mistura de solventes for usada, a seletividade tende a ser maior quando o solvente de maior força eluente estiver em percentagem superior a 50% na mistura.
4. Se para uma determinada mistura de solventes o valor de Rf obtido for muito elevado, é conveniente alterar drasticamente a força eluente da mistura.
Destas tendências gerais, estão corretas somente as de números
A constante de equilíbrio para a dissociação de um mol ácido monoprótico em 1 litro de água é aproximadamente 1x10-5 à temperatura de 25 ºC. Se a pressão é constante, o valor aproximado da variação na energia de Gibbs (kJ mol-1) para essa reação é de
DADOS:
Constante dos gases ideais = 8,31 J K-1 mol-1 Log10 e = 0,434
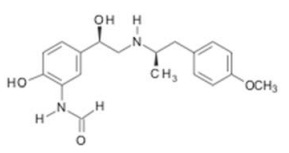
A análise da fórmula estrutural abaixo permite identificar as funções orgânicas
O Diagrama de Orbitais Moleculares (DOM) para o íon molecular H2 + pode ser obtido pela Combinação Linear de Orbitais Atômicos (CLOA) das funções de onda normalizadas que designam o orbital s de um átomo de hidrogênio a, representado como 1sa, com a função onda normalizada do átomo de hidrogênio b, representado como 1sb. Essas combinações lineares estão mostradas abaixo:

A ordem de ligação em H2 + é
Dado: 1H = 1s1.
A figura abaixo mostra a curva de titulação de uma base fraca por um ácido forte.
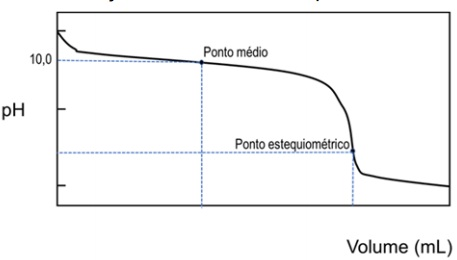
O Kb dessa base é
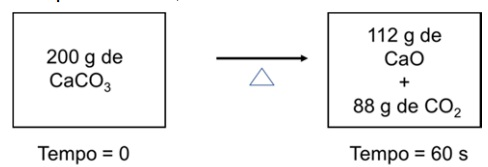
O acúmulo total de massa, em gramas, para a decomposição térmica do carbonato de cálcio em um sistema fechado, representado pelo esquema abaixo, é
Abaixo está a equação química não balanceada para a redução do dicromato de sódio por sacarose.
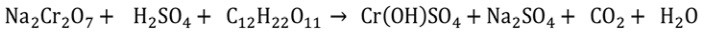
O número de mol de dicromato de sódio necessário para reduzir um mol de sacarose é
Pode-se considerar que o processo Rasching de produção de hidrazina (N2H4), que envolve a oxidação de amônia, ocorre em três etapas consecutivas, representadas pelas equações químicas não balanceadas na sequência abaixo:
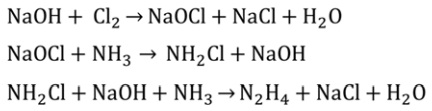
Assim, o número de mol de amônia necessários para a produção de dois mol de hidrazina é
A massa atômica relativa dos elementos é obtida pela determinação da média ponderada de seus isótopos. Dentre os elementos do grupo 14 da tabela periódica, mostrados abaixo, o que apresenta maior incerteza na sua massa atômica relativa é o
Elemento: C; Si; Ge; Sn; Pb
Massa Atômica relativa (u): 12,011; 28,086; 72,61(2); 118,71; 207,2
Adicionaram-se lentamente 5,0 mL de ácido sulfúrico concentrado (pureza 0,98% m/m) em 100 mL de água destilada e completou-se, com água destilada, até o volume de 500 mL. A normalidade da solução resultante é, aproximadamente,
Dados para o H2SO4:
Massa molar = 98 g mol-1.
Densidade = 1,84 g mL-1.