Questões de Concurso Público UFSM 2022 para Técnico de Laboratório - Química
Foram encontradas 50 questões
No quadro a seguir são mostrados os valores dos dados obtidos em várias determinações da análise do grau de pureza de uma amostra de cobre.
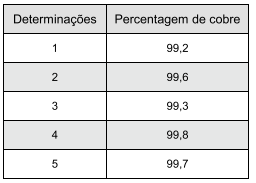
Com relação à determinação feita e aos dados obtidos, analise as alternativas a seguir.
I - O valor médio calculado é de 99,5.
II - Para calcular o erro absoluto, é necesssário conhecer apenas a média dos valores medidos.
III - A estimativa do desvio padrão para a análise do grau de pureza da amostra será expresso pela fórmula
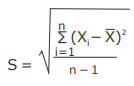
Está(ão) correta(s)
Um laboratório recebeu uma amostra de calcário para que fosse analisado o seu grau de pureza. Pela decomposição de 240 g de calcário, foram produzidos 107 g
CaCO3 (s) → CaO (s) + CO2 (g)
A pureza encontrada, em percentagem, teve seu
valor mais próximo de
Qual a massa de KMnO4, em gramas, que deve ser pesada para a preparação dessa solução?
A reação que ocorre entre o permanganato de potássio e os íons Fe2+, em meio ácido, é representada pela equação não balanceada
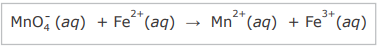
Em relação à reação, considere as afirmativas.
I - São necessários 4 íons H+ nos reagentes para balancear essa equação.
II - O íon Fe2+ é o agente redutor nessa reação.
III - O número de oxidação do íon manganês varia de +4 no reagente para +2 no produto.
Está(ão) correta(s)
Em um laboratório didático, para ensinar a tabela de potencial-padrão de redução (E0), foi construída uma pilha usando limão como eletrólito, conforme a figura.

Fonte: www.preparaenem.com/quimica/pilha-limao.htm
O laboratório dispunha dos metais apresentados no quadro a seguir.

Foi escolhido um fio de zinco como ânodo. Para que
a cela seja espontânea, como cátodo pode(m) ser
escolhido(s)
Para a conservação de carnes, uma estratégia usada desde a Antiguidade é o uso de salmoura, solução de NaCl em água, em concentrações de sal, que pode variar de 10 a 30%.
Considerando que a osmose seja o principal processo responsável pela conservação da carne, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) A solução é considerada hipotônica em relação às células.
( ) Há fluxo de água do interior das células para o meio externo a elas.
( ) As células vão desidratar e encolher.
A sequência correta é
Um laboratório de controle de qualidade de fármacos recebeu uma cartela com comprimidos de um determinado lote de medicamento para que fosse determinada a sua pureza.
Considerando essas informações, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) A cartela recebida é considerada uma amostra, pois se trata de uma fração da população.
( ) A população inclui todos os medicamentos fabricados nesse determinado lote.
( ) O resultado da análise de pureza obtido para os comprimidos dessa cartela deve ser submetido a tratamentos estatísticos para que represente toda a população.
A sequência correta é
O iso-octano é o constituinte que está em maior proporção na gasolina automotiva. Para que a combustão desse hidrocarboneto seja completa, de acordo com a equação, qual será a razão molar
C8H18 : O2?
Considere a equação não balanceada
C8H18(l) + O2(g) → CO2(g) + H2O (g)
Para a obtenção de óxido de ferro (II), foi realizado um experimento em triplicata, envolvendo a queima de limalha de ferro. As massas, em gramas, de ferro e oxigênio usadas e os resultados do experimento estão relacionados no quadro a seguir.
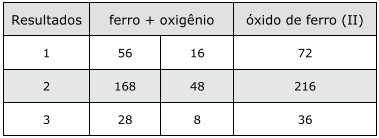
Com relação aos resultados obtidos, analise as afirmativas a seguir.
I - A razão das massas encontrada entre o ferro e o oxigênio é de 7/2.
II - No óxido de Fe(II), a proporção entre as massas de ferro e oxigênio será sempre constante.
III - A composição percentual de FeO será 70% de ferro e 30% de oxigênio.
Está(ão) correta(s)
Na reação de iodeto de potássio e nitrato de chumbo, forma-se um sólido amarelo, que é o iodeto de chumbo, conforme a equação
2 KI (aq) + Pb(NO3)2
(aq) → 2 KNO3
(aq) + PbI2
(s)
A maneira correta de separar os produtos será por
Na escolha de um recipiente adequado para o experimento, qual é aquele com o menor volume, em litros, capaz de conter o gás?
Em relação à preparação descrita, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) Como o estudante usou a espátula para juntar o material derramado na bancada, toda a massa pesada inicialmente foi usada.
( ) O NaOH é um composto considerado padrão primário.
( ) A vidraria usada para o preparo da solução é denominada vidraria graduada.
( ) A solução preparada trata-se de uma solução grosseira.
A sequência correta é
Em locais onde neva, é costume colocar sal (NaCl) sobre ruas e calçadas, pois facilita a fusão do gelo. Em um experimento de laboratório, os estudantes de uma classe de Química tentaram simular o que se observa, mas, nesse caso, comparando dois recipientes, um contendo gelo e sal, e outro, gelo e açúcar.
Analise as afirmativas a seguir em relação ao experimento dos estudantes.
I - Ambos os compostos usados dissolveram-se facilmente na água.
II - O sal foi mais eficiente no processo de fusão do gelo, pois um mol de NaCl tem o dobro de solutos do que um mol de açúcar.
III - O ponto de congelamento da água aumentou pelas interações entre ela e os solutos, em relação à água pura.
Está(ão) correta(s)
Para trabalhar em laboratórios químicos, devem ser levadas em conta muitas precauções e cuidados.
Assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) A proteção para olhos é obrigatória em qualquer experimento.
( ) Em dias de muito calor, pode-se trabalhar de bermuda ou saia, desde que o avental seja bem comprido.
( ) Para introdução de tubos de vidro em rolhas perfuradas, é aconselhado lubrificar primeiramente o vidro e fazer uso de um pano ou luvas para segurá-los.
( ) Experiências que envolvam materiais muito tóxicos devem ser conduzidas em capelas de exaustão.
A sequência correta é
I - A concentração molar da solução de íon Fe2+ é 0,0005 mol/L.
II - A concentração molar da solução de FeSO4.7H2O é 0,005 mol/L.
III - A concentração percentual (massa/volume) da solução de íon Fe2+ é 13,9%.
IV - A concentração percentual (massa/volume) da solução de FeSO4.7H2O é 0,139%.
Está(ão) correta(s)
A dureza da água é definida pela quantidade de alguns íons dissolvidos, como carbonatos, sulfatos, cálcio e magnésio. Para a determinação da dureza total, faz-se necessária a determinação destes íons de maneira seletiva. Como exemplo, a determinação de íons Ca2+ em águas envolve com frequência a titulação complexométrica com o reagente etilenodiaminotetra-acetato dissódico (Na2 EDTA).
Com esse propósito, um químico preparou uma solução do sal Na2EDTA di-hidratado (peso molecular = 372,0 g) pela dissolução de 0,140 g em 250 mL de água desionizada.
Com relação a essa solução preparada, qual sua concentração molar (mol/L)?
( ) O eletrodo combinado possui dois eletrodos de referência (Ag/AgCl) que medem a diferença de potencial elétrico por meio da membrana de vidro.
( ) O eletrodo combinado possui um bulbo de vidro com um anel externo de prata metálica (Ag) sensível a íons H+.
( ) O termo eletrodo de vidro combinado é sinônimo de eletrodo de vidro, tendo a mesma estrutura e funcionamento.
( ) As principais interferências para esse tipo de eletrodo são os íons metálicos alcalinos, como o Na+, Li+ e K+.
A sequência correta é