Questões de Concurso Público UFSM 2022 para Técnico de Laboratório - Química
Foram encontradas 50 questões
O ácido fosfórico é um reagente amplamente utilizado nas indústrias alimentícias, têxtil e metalúrgica. Na fabricação de fertilizantes, o H3PO4 também é frequentemente empregado na produção de superfosfatos. Em laboratórios de análises químicas, o H3PO4 é frequentemente utilizado para o preparo de soluções aquosas destinadas à realização de um grande número de procedimentos. Esse ácido se dissocia em água de acordo com as seguintes reações de hidrólise:
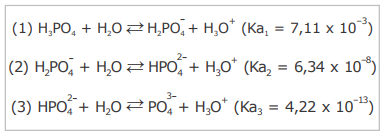
A partir das reações demonstradas acima, considere as seguintes afirmativas.
I - A partir da dissociação do H3PO4, três bases conjugadas são formadas na solução em equilíbrio químico.
II - A etapa (3) de dissociação libera a maior concentração de íons hidrônio (H3O+) na solução em equilíbrio químico.
III - A concentração do ânion 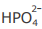 é maior que a concentração do ânion
é maior que a concentração do ânion 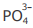 na solução em equilíbrio 4
químico.
na solução em equilíbrio 4
químico.
IV - A concentração do ânion 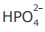 é maior que a concentração do ânion
é maior que a concentração do ânion 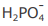 na solução em equilíbrio químico.
na solução em equilíbrio químico.
Estão corretas
Resíduos de metais pesados gerados em laboratório químico podem ser tratados por reação de precipitação com carbonato, geralmente na forma de calcário. O sólido obtido é filtrado em papel e armazenado, sendo que o líquido filtrado é neutralizado antes do descarte. Para a separação de resíduos dos íons metálicos Pb2+ , Cd2+ e Cu2+, a precipitação ocorre de acordo com as seguintes reações:

Em relação às reações de precipitação e seus produtos de solubilidade (Kps), considere as afirmativas a seguir.
I - Cu2+ é o íon mais insolúvel da mistura na precipitação com íon 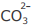
II - Pb2+ é o íon mais solúvel da mistura na precipitação com íon 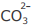
III - Cd2+ é mais insolúvel do que Cu2+ e Pb2+ na
precipitação com íon 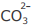
Está(ão) correta(s)
O quadro abaixo apresenta potenciais-padrão (E0) para semirreações de redução de cinco elementos.
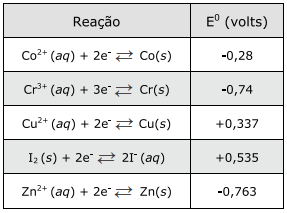
A ordem crescente de poder redutor conforme as
reações de redução acima é
O cloreto de prata (AgCl) é um sal pouco solúvel em água pura, com um produto de solubilidade (Kps) igual a 1,8x10-10. Quando em contato com a água, apresenta uma baixa concentração de íons Ag+(1,34x10-5 mol/L) e íons Cl- (1,34x10-5 mol/L) no equilíbrio químico em solução devido à reação
AgCl(s) ⇄ Ag+ (aq) + Cl- (aq)
Em qual das soluções a seguir o sal AgCl será mais
insolúvel, quando comparado com a água pura?
SOLUÇÃO 1 - 10 mL da solução estoque (2,010 mol/L) foi pipetado e transferido para um balão volumétrico de 100 mL, onde o volume foi completado com água desionizada.
SOLUÇÃO 2 - 5 mL da SOLUÇÃO 1 foi pipetado e transferido para um balão volumétrico de 50 mL, onde o volume foi completado com água desionizada.
As concentrações finais da SOLUÇÃO 1 e SOLUÇÃO 2 são, respectivamente,
A precisão e a exatidão das medidas de um método analítico são fundamentais para a garantia da qualidade dos resultados obtidos. Medidas inexatas em um laboratório podem acarretar erros de interpretação de um determinado fenômeno, perda de produção na indústria, tratamentos equivocados e desperdício de energia em diversos setores produtivos e na sociedade. Portanto, todo método analítico deve apresentar um grau minimanente aceitável de precisão e exatidão dos resultados. Para isso, análises comparativas entre métodos independentes e análises de materiais de referência certificados devem ser realizadas para determinação desses parâmetros a partir dos resultados experimentais.
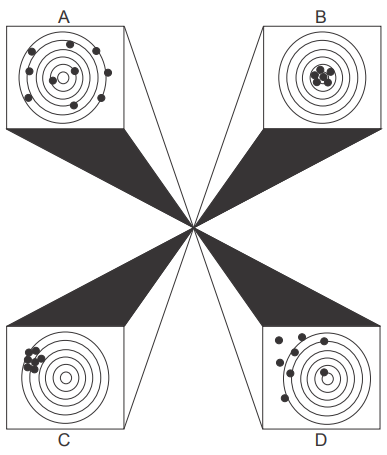
A figura a seguir ilustra quatro situações hipotéticas que podem acontecer nos resultados de medição por um determinado método analítico.
Fonte: Cienfuegos, Freddy. Estatística aplicada ao laboratório:
Rio de Janeiro: Interciência, 2005. p.7. (Adaptado)
Nesta figura, o centro do alvo simboliza o resultado esperado para as medidas repetidas em relação ao certificado de referência da amostra analisada. De acordo com essa definição, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) Na situação A os resultados são imprecisos.
( ) Na situação B os resultados são inexatos.
( ) Na situação C os resultados são precisos, mas inexatos.
( ) Na situação D os resultados são imprecisos, mas exatos.
A sequência correta é
I - A absortividade molar de um composto aumenta com a sua concentração.
II - A absorvância e a absortividade molar do composto são inversamente proporcionais.
III - As dimensões do percurso ótico utilizado no colorímetro influenciam diretamente na quantidade de luz absorvida pelo composto.
IV - A absorvância medida para o composto de concentração "X" duplica, se a sua concentração passar para "4X" na medida colorimétrica com um percurso ótico de igual dimensão.
Está(ão) correta(s)
Para a determinação colorimétrica de um composto "X" na faixa de concentração de 1 a 8 mg/L, um analista realizou a medida de absorvância para 4 padrões em um colorímetro de bancada. A curva de calibração preparada pelo analista pode ser visualizada na figura.
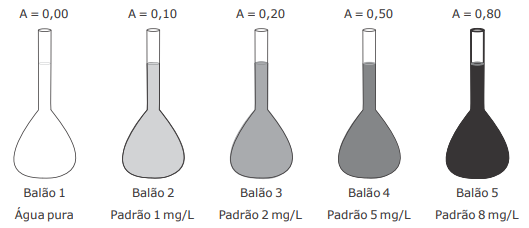
Sabendo que a análise do composto "X" deve apresentar absorvância no intervalo entre 0,10 e 0,80 e que o
rótulo da amostra contendo o composto "X" indica uma concentração de 2000 mg/L, considere as afirmativas
a seguir.
I - A amostra precisa ser diluída 100 vezes para que possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
II - 1 mL da amostra deve ser pipetado em um balão volumétrico de 500 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
III - 5 mL da amostra devem ser pipetados em um balão volumétrico de 500 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
IV - 1 mL da amostra deve ser pipetado em um balão volumétrico de 250 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
Está(ão) correta(s)
As figuras a seguir ilustram quatro curvas de titulação volumétrica de neutralização (A, B, C e D), envolvendo ácidos e bases de concentrações iguais.
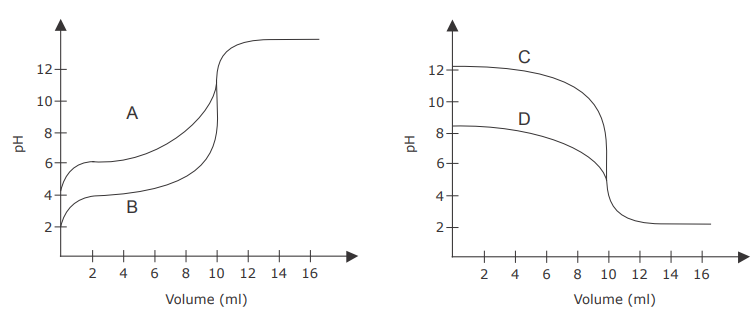
Em relação às curvas de titulação da figura, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) A curva "A" representa a titulação de um ácido fraco com uma base forte.
( ) A curva "B" representa a titulação de um ácido muito fraco com uma base forte.
( ) A curva "C" representa a titulação de uma base fraca com um ácido forte.
( ) A curva "D" representa a titulação de um ácido fraco com uma base forte.
A sequência correta é