Uma bola é inflada com 0,005 L de um gás ideal e está inici...
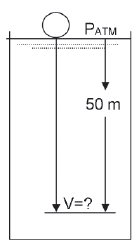
Qual o volume dessa bola, quando ela atingir a profundidade de 50 metros?
Dado A temperatura é constante e igual a 25°C. 1 atm = 10 m
Comentários
Veja os comentários dos nossos alunos
Equação dos gases ideais: PV=RT. Assim, o produto PV/T é igual a uma constante, R.
Fazendo P1*V1/T1 = P2*V2/T2 e substituindo os valores informados no enunciado:
P1=1 atm, V1=0,005 L, T1=25°C, P2= 5atm (pois são 50 m de coluna d'água) e T2=25°C
Obtemos que V2=0,001 L.
Realizando a conversão de que 1 L = 10^3 cm³ chegamos a V2 = 1 cm³.
Somente uma observação na resolução da colega Isabela.
Apesar de os cálculos estarem corretos a interpretação da P2 está errada, pois o correto é que a P2 seja = 6 atm e não a 5 atm, pois além de haver os 5 atm dos 50 m da coluna de água é necessário também contabilizar a Pressão atmosférica acima da água, resultando em 6 atm.
Neste caso o V2 seria igual a 0,833 cm3, aproximando grosseiramente chegaria na resposta do exercício de 1 cm3.
A meu ver caberia recurso na questão, por não constar a palavra "aproximadamente" no enunciado. Pois está incorreto considerar a P2 como 5 atm, sendo que o correto é 6 atm.
Concordo em grau, número e gênero com nosso amigo @Murilo Cadamuro Maida.
Uma outra questão da prova de 2018 da BR que fala sobre o PNEU DA BICICLETA, que era pra utilizar exatamente essa relação dos gases ideais, eles consideraram a Patm nos cálculos.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo