A Equação de Arrhenius, k = k0 exp(-E/RT), pode ser escrita...
T (°C) T (K) K (L mol-1 s-1) ln k 161,63 434,78 148,42 5,00 104,20 377,35 1 0 60,18 333,33 0,0067 -5,0
A partir desses dados plotados na Figura abaixo, calcula-se a Energia de Ativação desta reação.
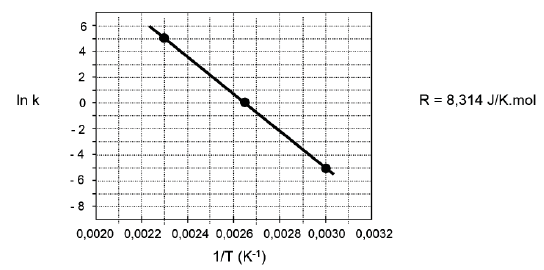
O valor da Energia de Ativação expresso em Joules/mol é
Comentários
Veja os comentários dos nossos alunos
Esse exercício é meio "cruel" por conta dos arrendondamentos (bem usado para se ganhar tempo, e na impossibilidade de usar uma calculadora), dado que as diferenças entre as respostas é muito pequena. Usando duas casas decimais, cheguei nos 119000, que é a mais próxima de B.
Conhecendo-se 2 pontos: (0,0023,5) e ( 0,0030, -5) . calculei a equação da reta:
Y=( -10/7exp-4 ) X + 0,0265
por analogia
-E/R = -10/0,0007
E= 118771,42 J/mol
Basta saber calcular o coeficiente angular.
Coef. angular = (yb - ya) / (xb - xa) = (-E/R)
[5 - (-5)] / (0,0023 - 0,003) = - (E / 8,314)
E = 118771 J/mol
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo