O espectro de massa abaixo é de um composto puro, cuja fórmu...
O espectro de massa abaixo é de um composto puro, cuja fórmula química é
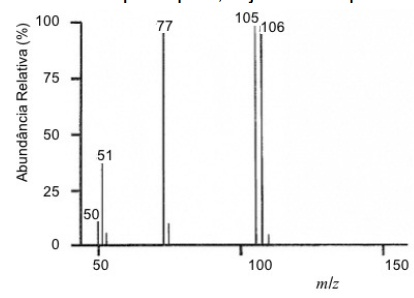
Dados: Massas atômicas (u)
H = 1; C = 12; O = 16; F = 19; Br = 80
Comentários
Veja os comentários dos nossos alunos
Não basta saber que a massa do íon molecular é 106. Tem que saber que o fragmento 105 é típico de aldeídos que perdem um hidrogênio. A ressonância torna o íon restante estável, daí a alta abundância. Ou seja, D e não E. As demais alternativas são eliminadas observando-se a massa do composto.
I) Após a retirada do hidrogênio (106-105 = 1), verifica-se a perda de um fragmento de massa m/z 28 (105 - 77 = 28 ) correspondente ao grupo CO.
II) Então percebe-se que há presença de oxigênio na composição química desse composto.
III) Logo, elimina-se TODAS as alternativas que não possuem oxigênio em sua estrutura molecular. Neste caso, resta apenas a alternativa D.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo