Uma determinada quantidade de gás hélio foi estudada em lab...
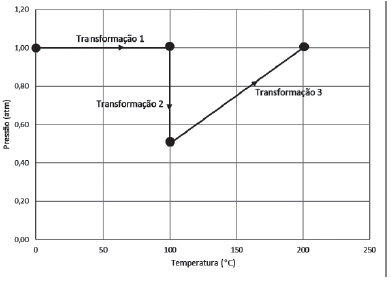
Considerando-se o hélio um gás ideal, a transformação
Comentários
Veja os comentários dos nossos alunos
Nossa, que questão legal hehe!
Confesso que fui fazer análise gráfica e errei, mas foi uma questão muito inteligente, para resolve-la sem medo de errar recomendo usar as fórmulas!
Na transformação 1, temos:
(P1*V1) / T1 = (P2*V2) / T2
Se a pressão é constante e houve um aumento de temperatura, certamente a V2 tem que aumentar, se V2>V1, então houve uma expansão isobárica, lembrando que a temperatura e o volume variaram.
Na transformação 2, temos:
(P1*V1) / T1 = (P2*V2) / T2
Se a temperatura é constante e houve uma diminuição de pressão, certamente a V2 tem que aumentar, se V2>V1, então houve uma expansão isotérmica, lembrando que a pressão e o volume variaram.
Na transformação 3, temos:
(P1*V1) / T1 = (P2*V2) / T2
Neste caso temos um aumento de temperatura e também de pressão, ou seja, temperatura e pressão variam, ao substituir os valores do gráfico na fórmula veremos que os volumes são iguais, ou seja, processo isocórico.
Conforme mencionei, a questão é um pouco casca grossa, para fazer com analise gráfica, acredito que a forma mais segura seja analisar as fórmulas, pelo menos foi para mim né, que fui analisar o gráfico e errei hehe! Qualquer erro na digitação, por gentileza, me comunique!
LETRA D
Fala galera, querem dicas de concursos da área técnica e um excelente material, sigam esse Instagram @ConcursosMinerva ou acessem o site: www.concursosminerva.com.br
Na equação geral dos gases PV = nRT a temperatura é em Kelvin.
Usando a relação (P1*V1) / T1 = (P2*V2) / T2 com a temperatura em K daria a letra E e não D.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo