Considere um experimento de decomposição térmica de clora...
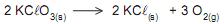
Sendo o volume molar igual 22,4 L/mol (na condição normal de temperatura e pressão), o volume máximo de oxigênio que pode ser obtido a partir da decomposição de 4,00 mol de KCLO3 , com o rendimento percentual de 90%, em L, é
Comentários
Veja os comentários dos nossos alunos
Oi, vim aqui pra deixar uma dica de um site para estudo de química com foco em concursos públicos. Baixe resumos de química grátis no site: http://quimicaparaconcursos.com e bons estudos!
1° PASSO: Determinar a quantidade de matéria formada de O2, a partir da decomposição de KClO3
2 mol KClO3 -------- 3 mol O2
4 mol KClO3 -------- x mol O2
x = 6 mol de O2
2° PASSO: Determinar o volume contido em 6 mol
22,4 L --------- 1 mol
x L ----------- 6 mol
x = 134,4 L
3° PASSO: Conhecer o valor, em L, de 90%.
134,4 L -------- 100 %
x L -------------- 90 %
x = 120,93 L ou 121L
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo