Considere uma solução aquosa de ácido acético 0,1 mol/L e...
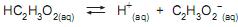
A uma dada temperatura, a constante de equilíbrio (Ka ) é igual a 1 x 10-5 . A concentração da espécie química H+ na solução em equilíbrio é
Comentários
Veja os comentários dos nossos alunos
1 - CÁLCULO DA CONCENTRAÇÃO DE H+
CH3COOH (aq) < ==== > CH3COO (aq) + H+ (aq)
OS PRODUTOS DA REAÇÃO ESTÃO NA MESMA PROPORÇÃO, PORTANTO SUAS CONCENTRAÇÕES SERÃO IGUAIS
Kb = ( [X] x [X] ) / ( [CH3COOH] )
1 x 10^-5 = [X]² / 0,1
[X] = √( 1 x 10^-6)
[H+] = 1 x 10^-3 mol/L
ALTERNATIVA C !!!!!!!!!!
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo