Observe os efeitos do deslocamento do equilíbrio químico qu...
Equação de Equilíbrio da Solução 1:
2 CrO4-2 (aq) + 4 H+ (aq)
 Cr2O7 -2(aq) + 2 H2O (l)
Cr2O7 -2(aq) + 2 H2O (l) Equação de Equilíbrio da Solução 2:
[CoCl 4] -2 (aq) + 4H2O(l)
 [Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0
[Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0 Com base nas informações acima, foram feitos quatro experimentos, com as duas soluções, levando-se em conta as condições para observação do deslocamento do equilíbrio químico. Os resultados foram tabelados abaixo.
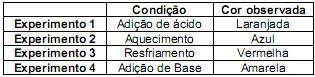
São informações corretas a respeito do estudo efetuado acima, exceto uma. Assinale a alternativa que a apresenta.
Comentários
Veja os comentários dos nossos alunos
a) Correta. Quando o ΔH < 0 é porque a reação é exotérmica.. Nesse caso, a reação inversa é favorecida pelo aumento da temperatura, resultando no aumento da formação dos reagentes.
b) Correta. Adição de ácido aumenta a concentração de H+ no meio favorecendo a formação dos produtos.
c) Correta. No equilíbrio a velocidade das reações diretas e inversas são iguais, isto é, os reagentes e os produtos são consumidos na mesma proporção.
d) Correta. Isso é o inverso do que é afirmado na letra A.. Agora a diminuição da temperatura favorecerá a formação dos produtos.
e) ERRADA. Todas as espécies descritas na equação 1 estão no equilíbrio... Entendo que isso é diferente dele perguntar se essas espécies fazem parte da constante de equilíbrio, espécies sólidas e líquidas não são incluídas porque suas concentrações são constantes.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo