A figura seguinte representa o processo de eletrólise empreg...
A figura seguinte representa o processo de eletrólise empregado na purificação de cobre, no qual por uma solução de sulfato de cobre (CuSO4) passa uma corrente elétrica que promove uma deposição de 8,50 g de cobre no cátodo.
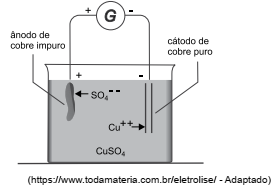
Dados: massas molares Cu=64g; O=16g; S=32g.
Nesse experimento, com base na massa de deposição
de Cobre no cátodo, a massa, em gramas, de sulfato de
cobre (CuSO4) decomposta foi de
- Gabarito Comentado (1)
- Aulas (10)
- Comentários (2)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Dados:
massa do cobre (mCu) = 8,5 g;
massas molares (g/mol): Cu = 64; O = 16; S = 32.
Resolução:
A partir da massa molar do cobre podemos calcular a quantidade em mols desse elemento uma vez que em 1 mol de Cu há 64 g:
1 mol de Cu possui 64 g
X ------- 8,5
X = 8,5/64 = 0,133 mols
Com o número de mols de cobre podemos saber o número de mols do enxofre (S) e do oxigênio (O), já que o CuSO4 possui a relação de: 1 mol de Cu : 1 mol de S : 4 mols de O. Logo, temos no composto CuSO4: 0,133 mol de Cu + 0,133 mol de S + 4 ∙ 0,133 mols de O
Como a questão requer a massa em gramas do CuSO4 é preciso transformar os valores de mols para gramas utilizando a massa molar, já que:
m = n ∙ MM
Em que m é a massa e n o número de mols.
mS = 0,133 ∙ 32 = 4,25 g
mO = 0,532 ∙ 16 = 8,5 g
Gabarito do Professor: Letra D.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Letra D
Aqui está minha resolução:
https://docs.google.com/document/d/1O_uoy7LD737Wc6KDk9e3-MvetZYotwS2wmqQKIzBWRs/edit?usp=sharing
CuSO4 = 160g/mol
64g de cobre necessita de 160g de CuSO4, fazendo regra de três, 8,5g de cobre necessitou de 21,25g de CuSO4
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo