Razões econômicas e ambientais indicam a necessidade de recu...
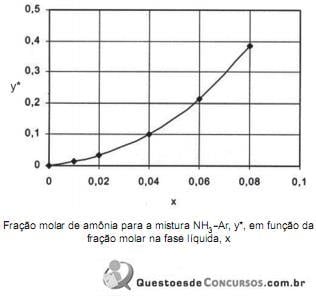
Razões econômicas e ambientais indicam a necessidade de recuperar uma corrente de gás contendo 30% de amônia e 70% de ar, em volume. Para tal, um engenheiro químico pretende utilizar uma torre de absorção que opera em contracorrente com água limpa, a uma pressão de 1 bar.
Considerando os dados da figura acima para o equilíbrio NH3-Ar, qual é o número mínimo de moles de água necessário, para cada 100 moles de gás de entrada, para que se recuperem 99% da amônia?
Comentários
Veja os comentários dos nossos alunos
Questão topíssima.
É o seguinte, primeiro encontra-se o topo da coluna (entra líquido puro e sai gás isento de amônia)
No gás, sobram 0,3 mol de amônia e 70 mol de ar.
Frações molares
x1 = 0
y1 = 0,3/70,3 = aproximadamente zero, vai.
No fundo da coluna, sai líquido com amônia e entra gás rico em amônia
x0 = ?
y0 = 0,3
Marcando no gráfico o ponto (0,0), a reta de operação parte dalí até a reta horizontal y=0,3, para algum valor de x que não temos.
Como ele quer a vazão mínima de água, o número de estágios de equilíbrio na coluna tende ao infinito e a reta de operação toca a curva de equilíbrio.
Desse modo, fazendo reta de operação interceptar a curva de equilíbrio em y=0,3, obtém-se x0 = 0,07.
Com este valor, é possível calcular a quantidade de água utilizada, uma vez que esta é a fração molar da amônia na corrente (a corrente são 29,7 mol de NH3 removido do gás + a quantidade de água)
0,07 = 29,7/(29,7+L)
Resolvendo para L, encontramos:
L = 394,6 moles
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo