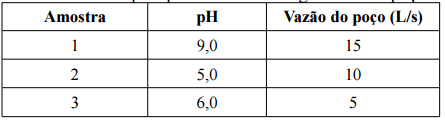
Em um município, foram coletadas amostras em três poços fre...
Sendo assim, o pH resultante desta mistura será:
- Gabarito Comentado (1)
- Aulas (12)
- Comentários (5)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Alguém poderia explicar.
pH = - log [H+]
[H+] = 10^-pH, em mol/L
Assim, a concentração de H+ de cada solução vai ser:
solução 1 = 10^-9 mol/L
solução 2 = 10^-5 mol/L
solução 3 = 10^-6 mol/L
Supondo que eles pegaram 1L de cada solução e como se trata da mesmas espécies na solução ( no caso o H+) a gente só soma a quantidade de mol
10^-9 mol +10^-5 mol + 10^-6 mol= 1,1x10^-5 mol em 3 Litros
agora faz a regra de tres :
1,1x10^-5 mol ------------------ 3 Litros
X mol ------------------------------ 1 L
X= 3,66 . 10^-6 mol/L
assim,
pH = - log (3,66 . 10^-6 ) = 5,435
Essa professora sabe muito!
Você não precisa supor a quantidade em litros, ele deu a vazão de cada poço.
É possível resolver por diluição:
Concentração de íons H+ nas soluções :
solução 1 = 10^-9 M
solução 2 = 10^-5 M
solução 3 = 10^-6 M
(C1 x V1) + (C2 x V2) + (C3 x V3) = Cf x Vf
(10^-9 x 15) + (10^-5 x 10) + (10^-6 x 5) = Cf x 30
Cf = 3,5 x 10^-6 M
pH = -log [H+]
pH = - (log 3,5 + log 10^-6)
pH = - (0,54 -6)
pH = 5,45
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo