A constante de equilíbrio KC para a seguinte reação é 0,80 a...
A constante de equilíbrio KC para a seguinte reação é 0,80 a uma dada temperatura. Um recipiente de 5,00L contém 0,4 mol de FeBr3, 0,5 mol de FeBr2 e 0,4 mol de Br2 nessa temperatura.
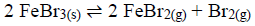
Com base no exposto, assinale a alternativa CORRETA.
Comentários
Veja os comentários dos nossos alunos
1) Achar a [mol/L] de cada composto:
FeBr3 = 0,4/5 = 0,08 mol/L
FeBr2 = 0,5/5 = 0,1 mol/L
Br2 = 0,4/5 = 0,08 mol/L
2) Calcular Q:
Q = [(0,1)^2 x (0,08)] / [(0,08)^2
Q = 0,125
3) Comparar Q e K:
Foi dado que k = 0,8. Logo, Q<K, e isso indica que há mais reagente que produto na reação, assim, pra estabelecer o equilíbrio, é necessário que a reação se desloque para a direita, no sentido de formar produtos.
1. Q>K1
- Vamos pensar novamente na expressão de Q . Nós temos as concentrações dos produtos, ou suas pressões parciais, no numerador e as concentrações dos reagentes, ou suas pressões parciais, no denominador.
- Isso sugere que nós temos **mais produto presente do que teríamos no equilíbrio**. Portanto, a reação irá tentar usar parte do *excesso de produto* e favorecerá a reação inversa para atingir o equilíbrio.
- 2. Q< K
- Nesse caso, a razão de produtos para reagentes é menor do que se o sistema estivesse em equilíbrio. Em outras palavras, a **concentração dos reagentes é maior do que durante o equilíbrio**; você pode também pensar nisso usando os produtos, que estariam com uma concentração baixa demais. Para atingir o equilíbrio, a reação irá favorecer a reação direta e tentará usar um pouco do *excesso de reagentes* para formar mais produtos.
- 3. Q=K
- Uhul! A reação já está em equilíbrio! As concentrações não mudarão, uma vez que as taxas das reações direta e inversa são iguais.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo