O íon potássio em 250,0 mL de uma amostra de água mineral fo...
O íon potássio em 250,0 mL de uma amostra de água mineral foi precipitado com tetrafenilborato de sódio:
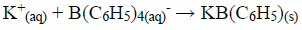
O precipitado foi filtrado, lavado e redissolvido em um solvente orgânico. Um excesso de quelato EDTA/mercúrio(II) foi adicionado:
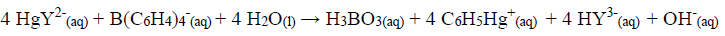
O EDTA liberado foi titulado com 30,00 mL de Mg2+ 0,0550 mol L-1.
(Dado: K = 39 g mol-1, Mg = 24 g mol-1)
Após a análise, a concentração aproximada do íon potássio em partes por milhão será:
Comentários
Veja os comentários dos nossos alunos
Questões de gravimetria sempre se resolve "de trás pra frente", portanto:
O EDTA complexa na proporção de 1:1 apesar do Magnésio ser Mg2+, calculando o número de mols de EDTA que foi titulado como Mg2+:
n = 0,03 (L) * 0,0550 (mol.L-1) = 0,00165 mol
Agora perceba pela reação (2) que 1 mol de tetrafenilborato forma 4 mols de EDTA. Calculando então o número de mols de tetrafenilborato:
n = (0,00165)/4 = 0,0004125 mol
Pela reação (1), 1 mol de tetrafenilborato reage com 1 mol de K+. Então o número de mols de K+ é o mesmo do tetrafenilborato.
Devemos calcular agora então a massa de K+:
m = 0,0004125 (mol) * 39(g.mol-1) = 0,01609 g = 16,09 mg
Como o volume da amostra era de 250 mL ou 0,25L, temos finalmente que:
[K+] = 16,09 (mg)/ 0,25(L) = 64,4n(mg/L) = 64,4 ppm
Qualquer erro me avisem.
Bons estudos, sucesso!
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo