A Figura abaixo é o diagrama de Pourbaix do Ferro (simplific...
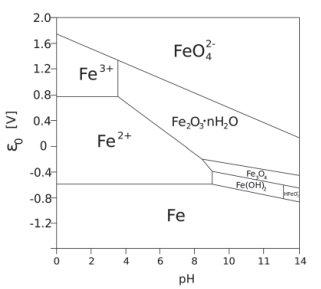 De acordo com esse diagrama, um cano de ferro imerso
na água com pH=7 poderá ser protegido da oxidação com
a aplicação de um potencial elétrico de
De acordo com esse diagrama, um cano de ferro imerso
na água com pH=7 poderá ser protegido da oxidação com
a aplicação de um potencial elétrico de Comentários
Veja os comentários dos nossos alunos
Não sei se estou falando besteiras, mas meu racioncínio foi o de estabelecer um potencial elétrico em que o ferro não se encontrasse de forma ionizada, gerando cargas que pudesse causar oxidação. Para o pH=7, o ferro encontra-se em seu estado de equilíbrio (Fe) aproximadamente menor que -0.5 V (pelo gráfico).
A resposta que atende a esse pré-requisito é a letra E.
A oxidação exige redução do ferro (perda de elétrons do átomo de ferro para o átomo de oxigênio, numa ligação iônica que forma o óxido de ferro). No diagrama, na região de baixo, o Fe com qualquer pH não há redução do ferro, logo não há oxidação.
na zona de passivação o metal não fica protegido tb?
como o oxido de ferro nao é passivador, deve se avaliar a area onde o elemento está em sua forma nao ionizada. Caso o diagrama fosse do alumínio ou do cromo, deveria se localizar a area onde ocorre a formação de oxidos
Essa questão é muito esquisita. Em pH = 7 e potencial -0,8 V temos uma região imunidade, logo não tem corrosão (não tem oxidação). Em potencial igual a 0,8 com pH = 7 cai numa região de passivação com o Fe2O3 hidratado, logo também não sofre oxidação, não sofre corrosão. Dava pra errar essa fácil fácil
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo