Muitas reações químicas ocorrem por mecanismos que envolvem ...
Etapa 1: 2 NO(g)
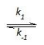 N2O2(g) (rápida, equilíbrio)
N2O2(g) (rápida, equilíbrio) Etapa 2: N2O2(g) + Br2(g)
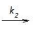 2NOBr (lenta)
2NOBr (lenta) A constante de velocidade para a reação entre óxido nítrico e bromo pode ser expresso em função das constantes k1, k-1 e k2 por meio da expressão:
Comentários
Veja os comentários dos nossos alunos
Meu raciocínio nessa questão foi que a constante de velocidade da reação é dada pela etapa lenta, e por isso as etapas K1 e K-1 devem se anular... A única alternativa que expressa isso é a letra A.
CORRIGA-ME se me equivoquei.
v1=k1*([NO]^2)
v-1=(k-1)*[N2O2]
v2=k2*([N2O2]*[BR2])
Se equilibrio, v1=v-1
k1*([NO]^2)=(k-1)*[N2O2]
k1*([NO]^2)/(k-1)=[N2O2]
Substituindo na expressão de v2,
v2=k2*([N2O2]*[BR2])
v2=k2*(k1*([NO]^2)/(k-1)*[BR2])
rearranjando
v2=k2*k1/(k-1)*([NO]^2)*[BR2])
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo