Os parâmetros termodinâmicos de uma reação química são de f...
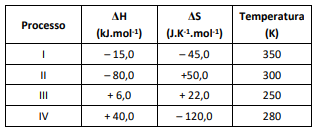
O processo espontâneo é o
- Gabarito Comentado (1)
- Aulas (8)
- Comentários (4)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Pela equação da energia livre de Gibbs:
ΔG = ΔH - TΔS
- Se ΔG < 0 a reação é espontânea
- Se ΔG> 0 a reação não é espontânea
Só que fiquei na dúvida, já que a reação III também resulta em ΔG < 0.
A questão III também não estaria correta ?? ?? Temperatura elevada, entropia positiva
Primeiro, vamos calcular a Energia livre de Gibbs pela equação ΔG = ΔH - TΔS, para cada processo:
I) ΔG = -15 -(350)*(-15) = +15785
II) ΔG = -80 -(300)*(50) = -15080
III) ΔG = 6 -(250)*(22) = -5494
IV) ΔG = 40 -(280)*(-120) = +33640
Para a reação ser espontânea, ΔG precisa ser negativo, ou seja ΔG < 0
Entre as opções, o menor valor obtido para o ΔG foi o processo II, logo a alternativa correta é a letra "b"
Somente pelo jogo de sinal resolvi está questão.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo