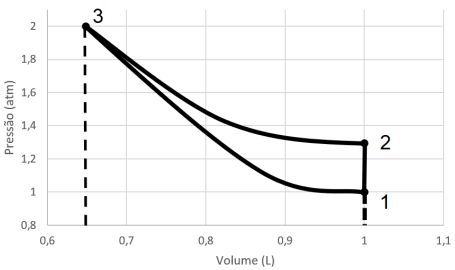
Sabendo que a constante universal dos gases é de 0,082 atm....
- Gabarito Comentado (1)
- Aulas (12)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Usando a equação PV = nRT, vc tira que a temperatura do ponto 1 é PV/nR ou seja,
T1 = 1atm.1L/0,04mols.0,082
T1 = 1 / (4.10^-2 × 8,2.10^-2)
T1 = 10^4 / 32,8 = 305K (aproximadamente)
Agora você aplica PV/T = cte para achar a T2
1.1/305 = 1,3.1/T2, T2 = 396K (aproximadamente)
Obs.: para achar a pressão no ponto 2, basta fazer o aumento percentual (1 atm × (100% + 30%) = 1.130/100= 1,3 atm
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo