A seguir, estão listados quatro métodos empregados para a se...
A seguir, estão listados quatro métodos empregados para a separação de misturas de CH4 e CO2.
I Absorção por água pressurizada: baseia-se na maior solubilidade em água do CO2.
II Criogenia: o resfriamento gradual da mistura faz que o componente com maior ponto de ebulição se liquefaça primeiro.
III Separação por membranas: o componente com menor diâmetro crítico apresenta maior capacidade de permeação.
IV Adsorção física seletiva do CO2 por sólidos porosos, como os carbonos ativados: a presença de grupos funcionais básicos na superfície do adsorvente (como, por exemplo, os ilustrados na estrutura abaixo) favorece o processo.
Considerando os métodos apresentados, julgue o item subsequente.
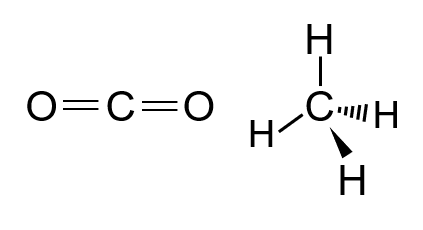
O CO2 apresenta geometria linear, e o CH4 tem geometria
tetraédrica. Na separação por membranas, essa diferença
favorece a permeação do CO2 através dos canais de membranas
semipermeáveis, na comparação com a permeação do CH4.
- Gabarito Comentado (1)
- Aulas (4)
- Comentários (3)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Gabarito do Professor: CERTO.

Gabarito do Professor: CERTO.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
O comprimento da ligação dupla, se comparada a simples. compreende menor diâmetro crítico, apresentando maior capacidade de permeação.
Certo. A geometria linear do CO2 ocupa um menor espaço, possuindo maior facilidade de passar pelos poros de uma membrana semipermeável. Gabarito: C
1. Geometria molecular:
• CO₂ (Dióxido de carbono): Geometria linear, ou seja, todos os átomos estão alinhados em uma única dimensão (plano). Isso torna a molécula mais compacta e facilita sua passagem por poros estreitos ou canais em membranas.
• CH₄ (Metano): Geometria tridimensional tetraédrica, com os átomos de hidrogênio distribuídos nos vértices de um tetraedro ao redor do átomo central de carbono. Essa estrutura tridimensional ocupa mais espaço efetivo, aumentando seu raio cinético e dificultando a passagem por membranas.
2. Planar vs. tridimensional: Quando uma molécula é linear ou planar, ela tende a ser mais “achatada” ou compacta, o que reduz seu tamanho efetivo. Quando a molécula é tridimensional, como no caso do CH₄, ela ocupa mais espaço em todas as direções, aumentando o seu volume efetivo.
3. Aplicação no caso CO₂ vs. CH₄: O CO₂, sendo linear e mais compacto, consegue permeiar mais facilmente por canais estreitos de membranas semipermeáveis. O CH₄, apesar de ter menos massa molecular (16 g/mol) que o CO₂ (44 g/mol), possui uma geometria tridimensional que o torna “maior” em termos espaciais, reduzindo sua permeabilidade.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo