O teor de grupos funcionais básicos em um carbono ativado f...
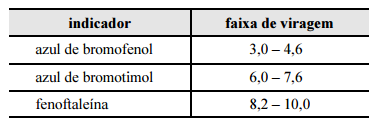
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Se o volume gasto da solução padrão de NaOH tiver sido igual a 9,0 mL, então o teor de grupos funcionais básicos presentes na amostra é superior a 0,60 mmol/g.
- Gabarito Comentado (1)
- Aulas (11)
- Comentários (2)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
mamostra = 1,000 g;
VHCl = 50,0 mL= 0,05 L;
MHCl = 0,1000 mol/L;
VHCl (alíquota) = 10,0 mL = 0,01 L;
MNaOH = 0,100 mol/L;
VNaOH = 9,0 mL = 0,009 L.
Resolução:
1) Primeiramente é necessário saber o número de mols (n) de HCl presentes na solução inicial que foi agitada com o carbono ativado, utilizando a concentração molar (M) e o volume da solução (V):
nHCl (inicial) = MHCl ∙ VHCl
nHCl (inicial) = 0,1 ∙ 0,05 = 0,005 mols = 5 mmols
2) Como o teor de grupos básicos no carbono ativado foi determinado a partir da diferença entre as concentrações inicial e final da solução ácida, é preciso saber quantos mmols de HCl não neutralizaram os grupos básicos do carvão ativado, ou seja, o número de mols remanescente, que pode ser calculado a partir da titulação com o NaOH, de acordo com a reação:
NaOH + HCl → NaCl + H2O
Como a relação entre HCl e NaOH é de 1:1, o número de mols dessas substâncias que reage é igual, logo:
nHCl (alíquota) = nNaOH
nHCl (alíquota) = MNaOH ∙ VNaOH
nHCl (alíquota) = 0,1 ∙ 0,009 = 0,0009 mols = 0,9 mmols
Com o número de mols presente na alíquota retirada para a titulação é possível saber o número de mols remanescente, que não reagiu com os grupos funcionais básicos:
0,9 mmols presentes em 10,0 mL
nHCl (remanescente) -------------- 50,0 mL
nHCl (remanescente) = 0,9 ∙ 5 = 4,5 mmols
3) Com o número de mols inicial e remanescente do ácido é possível saber o teor dos grupos básicos presentes no carvão:
nHCl (inicial) - nHCl (remanescente) = 5,0 - 4,5 = 0,05 mmols
Como a massa da amostra é de 1 g, o teor é igual a:
teor (grupos funcionais básicos) = 0,05 mmol/g
Portanto, o teor não é superior a 0,06 mmol/g, o que torna este item incorreto.
Gabarito do Professor: ERRADO.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
A PALAVRA SERIA CONCENTRAÇÃO E NÃO TEOR.
Quantidade inicial de ácido (em mol): 0,1 mol/L * 0,05 L = 5 mmol
Quantidade de ácido resultante após neutralizar os grupos funcionais básicos: primeiro calcula-se a concentração do ácido na alíquota de 10 mL:
MaVa = MbVb
10Ma = 9 * 0,1
Ma = 0,09 mol/L.
Em seguida, calcula-se a quantidade de ácido (em mol) presente nos 10 mL:
n = MaVa = 0,09 mol/L * 0,01 L = 0,9 mmol (em 10 mL)
Para calcular a quantd de ácido (em mol) presente nos 50 mL originais, basta multiplicar por 5, resultando em 4,5 mmol. Como a quantidade de ácido presente nos 50 mL é a mesma presente no 1g, podemos afirmar que a concentração resultante de ácido é de 4,5 mmol/g.
Para encontrar a concentração de grupos funcionais básicos, basta realizar a diferença entre a concentração inicial e final de ácido:
5-4,5 = 0,5 mmol/g.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo