O teor de grupos funcionais básicos em um carbono ativado fo...
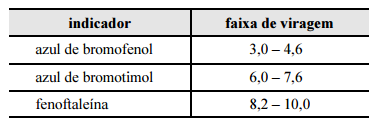
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Das informações da tabela infere-se que a fenoftaleína é o indicador que ocasiona o menor erro de titulação na titulação entre as soluções de NaOH e HCl.
- Gabarito Comentado (1)
- Aulas (11)
- Comentários (5)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Gabarito do Professor: ERRADO.
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Seria o azul de bromotimol pela faixa mais neutra.
O HCl e o NaOH são, respectivamente, ácido e base forte. Logo, na titulação, o ponto de equivalência é no pH 7.
O indicador melhor para essa titulação é o azul de bromotimol (faixa de viragem 6,0-7,6).
Um bom método para relembrar:
Ácido forte e base fraca -> faixa de viragem: meio ácido
Ácido fraco e base forte -> faixa de viragem: meio básico
Ácido forte e base forte -> Faixa de viragem: meio neutro
Discordo do gabarito, a faixa de viragem deve ser escolhida pela faixa inferior que mais se aproxima da faixa da reação, depois desta completa. O azul de bromotimol tem uma faixa de viragem que começa em 6, ou seja, antes da reação estar completa ele vai virar ocasionando um erro. Já a fenolftaleína tem uma faixa de viragem mínima em 8,2; ou seja, ela vai acusar que a reação ocorreu apenas quando esta estiver completa e não antes da sua ocorrência.
O que acontece com a fenolftaleína é que ela só aponta o pH da solução depois que a titulação acabou (todo o ácido foi consumido pela base), por isso ela gera um erro um pouco maior que o do azul de bromotimol.
"O pH da solução é 7,00 porque o cátion de uma base forte e o ânion de um ácido forte não hidrolisam e não têm efeito apreciável no pH." - BROWN. Química - A Ciência Central - 9 ed.
Das informações da tabela infere-se que a fenoftaleína é o indicador que ocasiona o menor erro de titulação na titulação entre as soluções de NaOH e HCl.
Conforme a tabela, a faixa de viragem da fenolftaleína ocorre entre pH 8,2 e 10,0, então ela é indicada para reações em que o ponto de viragem ocorre em pH básico, ou seja, entre soluções de ácido fraco e base forte.
Como o HCl e NaOH são respectivamente ácido forte e base forte, pela tabela o indicador que ocasiona menor erro É o azul de bromotimol e NÃO a fenoftaleína.
Gabarito: ERRADO
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo