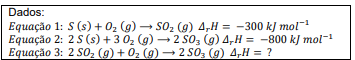Questões de Concurso Sobre química
Foram encontradas 13.369 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Dados: Constante de Faraday F = 9,5 x 104 C mol-1 Massas molares: Ca: 40 g mol-1; Cl: 35 g mol-1
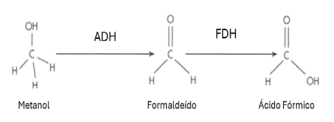
Disponível em: <https://www.anaesthesiamcq.com/AcidBaseBook/ab8_6a.php>. Acesso em: 21 jun. 2024. [Adaptado].
Qual é o número de oxidação do carbono no metanol e no ácido fórmico, respectivamente?
Dados: potenciais padrão de redução das semirreações:
Zn2+ (aq) + 2 e− ⟶ Zn (s) E0 = −0,76 V Bi3+ (aq) + 3 e− ⟶ B (s) E0 = +0,20 V
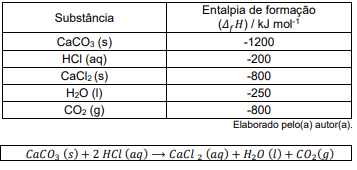
Dadas as entalpias de formação das substâncias listadas na tabela e considerando a equação acima, qual o valor da entalpia de reação para a reação, em kJ mol-1?