Questões de Concurso
Para fundepes
Foram encontradas 2.339 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Em relação aos aspectos éticos dessa pesquisa com seres humanos, dadas as afirmativas,
I. O único erro do laboratorista nessa pesquisa foi ter divulgado em suas redes sociais os dados dos pacientes.
II. O laboratorista é responsável pela integridade e bem-estar dos participantes da pesquisa.
III. A pesquisa não precisa de consentimento livre e esclarecido do participante, pois é de elevada relevância social.
IV. Essa pesquisa não traz nenhum risco ao paciente, pois os procedimentos a serem aplicados são de rotina na clínica.
verifica-se que está/ão correta/s apenas
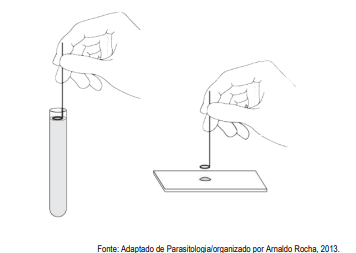
A figura representa qual método diagnóstico parasitário?
Com relação aos procedimentos de primeiros-socorros, assinale a alternativa correta.
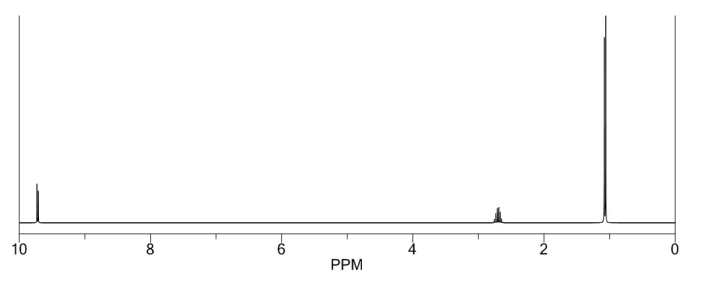
Com base no espectro, é possível afirmar que esse composto é
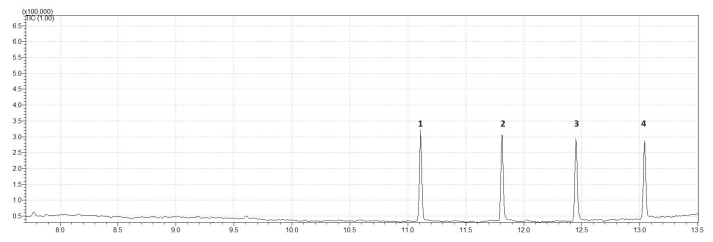
Com base nas informações supracitadas, os picos que aparecem no cromatograma correspondem a:
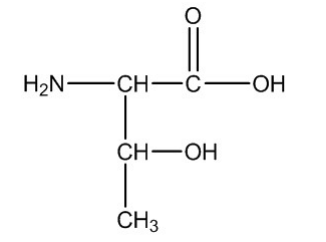
O nome, segundo a IUPAC, desse composto é
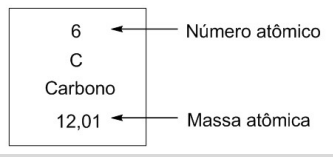
Essa diferença de massa atômica para o carbono pode ser atribuída à
Dado: massa molar do NaOH = 40 g/mol.
O composto em questão e o tratamento utilizado antes de seu descarte são, respectivamente,
De acordo com essas informações, assinale a alternativa que é um exemplo de mistura química.
Sobre o átomo de carbono do ponto de vista da TLV, assinale a alternativa correta.
Sobre o equilíbrio químico, dadas as afirmativas,
I. Para reações exotérmicas, quando a temperatura aumenta a composição da mistura em equilíbrio, há deslocamento em favor dos produtos e o oposto ocorre para as reações endotérmicas.
II. A energia livre de Gibbs pode ser relacionada à constante K, em que o ∆G t° (valor da energia de Gibbs no equilíbrio) é positivo; então, ln K (logaritmo natural da constante de equilíbrio) deverá ser negativo e, portanto, K < 1, indicando que os reagentes estão sendo favorecidos no equilíbrio químico.
III. A energia livre de Gibbs pode ser relacionada à constante K, em que o ∆G t° (valor da energia de Gibbs no equilíbrio) é negativo; então, ln K (logaritmo natural da constante de equilíbrio) deverá ser negativo e, portanto, K > 1, indicando que os produtos estão sendo favorecidos no equilíbrio químico.
verifica-se que está/ão correta/s
Qual das alternativas descreve corretamente o que ocorre durante essa reação?
Dados: C = 12,01; H = 1,01; Br = 79,91
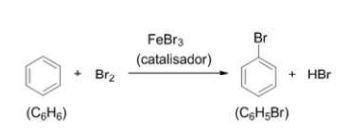
Determine o rendimento teórico do bromo-benzeno, quando 30 g de benzeno reage com 65 g de bromo.
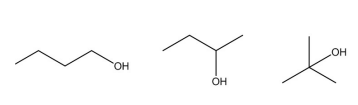
Dadas as afirmativas relacionadas a propriedades dos três isômeros do butanol da figura,
I. O 1-butanol apresenta o maior ponto de ebulição dentre os três compostos acima.
II. O 2-butanol apresenta o menor ponto de ebulição dentre os três compostos acima.
III. O 2-metil-2-propanol é o composto mais polar dessa série.
IV. O 1-butanol é o composto menos polar dessa série.
verifica-se que está/ão correta/s
O nome da vidraria usada e a concentração da solução de NaOH são, respectivamente,
Assinale a alternativa que apresenta a massa molecular (em u) do gás fétido liberado nessa reação. Dados da massa atômica em u: C = 12,01 u; H = 1,01 u; S = 32,07 u; O = 16,00 u; N = 14,01 u; Cl = 35,45 u.