Questões de Concurso
Para ufpa
Foram encontradas 545 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Adicionaram-se lentamente 5,0 mL de ácido sulfúrico concentrado (pureza 0,98% m/m) em 100 mL de água destilada e completou-se, com água destilada, até o volume de 500 mL. A normalidade da solução resultante é, aproximadamente,
Dados para o H2SO4:
Massa molar = 98 g mol-1.
Densidade = 1,84 g mL-1.
A massa atômica relativa dos elementos é obtida pela determinação da média ponderada de seus isótopos. Dentre os elementos do grupo 14 da tabela periódica, mostrados abaixo, o que apresenta maior incerteza na sua massa atômica relativa é o
Elemento: C; Si; Ge; Sn; Pb
Massa Atômica relativa (u): 12,011; 28,086; 72,61(2); 118,71; 207,2
Pode-se considerar que o processo Rasching de produção de hidrazina (N2H4), que envolve a oxidação de amônia, ocorre em três etapas consecutivas, representadas pelas equações químicas não balanceadas na sequência abaixo:
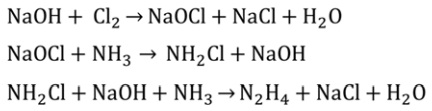
Assim, o número de mol de amônia necessários para a produção de dois mol de hidrazina é
Abaixo está a equação química não balanceada para a redução do dicromato de sódio por sacarose.
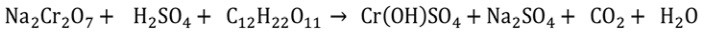
O número de mol de dicromato de sódio necessário para reduzir um mol de sacarose é
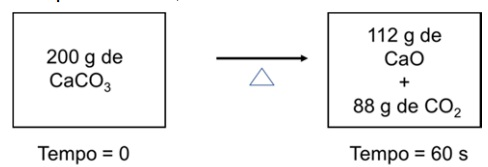
O acúmulo total de massa, em gramas, para a decomposição térmica do carbonato de cálcio em um sistema fechado, representado pelo esquema abaixo, é
A figura abaixo mostra a curva de titulação de uma base fraca por um ácido forte.
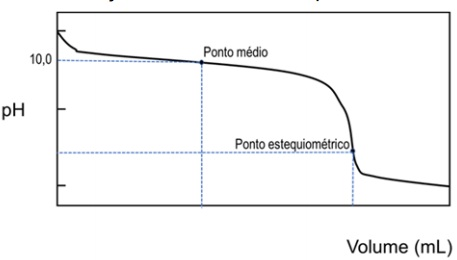
O Kb dessa base é
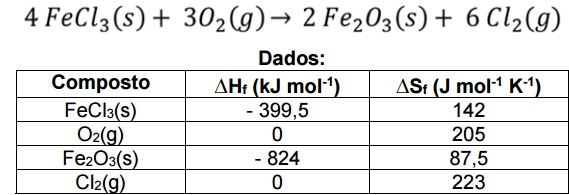
Para a equação química abaixo, ocorrendo a pressão constante e temperatura de 25 ºC, o valor de ∆G, em KJ, é aproximadamente
O Diagrama de Orbitais Moleculares (DOM) para o íon molecular H2 + pode ser obtido pela Combinação Linear de Orbitais Atômicos (CLOA) das funções de onda normalizadas que designam o orbital s de um átomo de hidrogênio a, representado como 1sa, com a função onda normalizada do átomo de hidrogênio b, representado como 1sb. Essas combinações lineares estão mostradas abaixo:

A ordem de ligação em H2 + é
Dado: 1H = 1s1.
O Diagrama de Orbitais Moleculares (DOM) para o íon molecular H2 + pode ser obtido pela Combinação Linear de Orbitais Atômicos (CLOA) das funções de onda normalizadas que designam o orbital s de um átomo de hidrogênio a, representado como 1sa, com a função onda normalizada do átomo de hidrogênio b, representado como 1sb. Essas combinações lineares estão mostradas abaixo:

A constante de normalização
Dado: S = Integral de Sobreposição
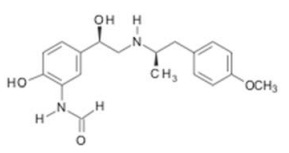
A análise da fórmula estrutural abaixo permite identificar as funções orgânicas
A constante de equilíbrio para a dissociação de um mol ácido monoprótico em 1 litro de água é aproximadamente 1x10-5 à temperatura de 25 ºC. Se a pressão é constante, o valor aproximado da variação na energia de Gibbs (kJ mol-1) para essa reação é de
DADOS:
Constante dos gases ideais = 8,31 J K-1 mol-1 Log10 e = 0,434
Em relação aos solventes (ou misturas deles) utilizados em cromatografia de camada delgada, são feitas algumas afirmações de caráter geral.
1. Aumentar a força eluente do solvente tende a diminuir a separação entre os componentes de uma amostra e aumentar Rf.
2. Diminuir a força eluente do solvente tende a aumentar a separação entre os componentes de uma amostra e diminuir Rf.
3. Se uma mistura de solventes for usada, a seletividade tende a ser maior quando o solvente de maior força eluente estiver em percentagem superior a 50% na mistura.
4. Se para uma determinada mistura de solventes o valor de Rf obtido for muito elevado, é conveniente alterar drasticamente a força eluente da mistura.
Destas tendências gerais, estão corretas somente as de números
Abaixo estão listados cinco compostos:
1. Sílica gel
2. Alumina
3. Terra diatomácea
4. Poliamida
5. Celulose
Dentre esses compostos, pode(m) ser utilizado(s) como adsorvente(s) para cromatografia em camada delgada
A figura abaixo esquematiza um cromatograma obtido por CLAE.
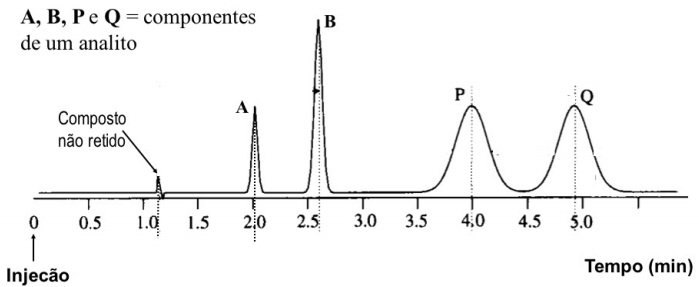
Pela análise desse cromatograma, conclui-se que
Cada curva na figura abaixo representa a mobilidade efetiva de uma espécie química em função do pH, utilizada para se determinar as condições de separação dessas espécies por eletroforese.
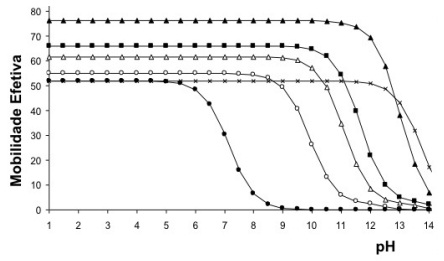
Fonte: PIOVEZAN, Marcel. Desenvolvimento de Metodologias por Eletroforese Capilar para Avaliação de Parâmetros Químicos da Qualidade de Biodiesel, 2010.70 f. Dissertação (Mestrado em Química) – PPGQ-UFSC, Florianópolis - SC. Adaptado.
Assim, o pH que deve ser utilizado para a separação de tais espécies por este experimento de eletroforese
deve ser
A determinação de cromo em água pode ser feita colorimetricamente, complexando o cromo com difenilcarbazida. A absortividade molar, a 540 nm, desse complexo é de 41.700 L mol-1 cm-1. Uma amostra de água foi analisada por esse método em uma cela de caminho ótico de 5 cm e obteve-se uma absorbância de 0,4. Assim, a concentração aproximada, em ppm, de cromo na solução é de
DADO:
Massa Molar Cromo (g mol-1) = 52
Dentre os cinco pictogramas relacionados à classificação de risco de reagentes químicos abaixo representados, o que se refere a um reagente oxidante é o de número.

É comum encontrar, em laboratórios, pipetas volumétricas que apresentam na parte superior uma marcação com um traço ou com dois traços, conforme representado na figura abaixo.
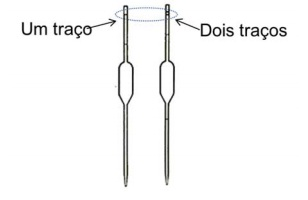
Esses traços indicam que