Questões de Concurso
Comentadas para copese - ufpi
Foram encontradas 1.717 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Leia o texto que segue e responda à questão.
Por que relacionamentos terminam, segundo Darwin


Callegari, Jeanne e Garattoni, Bruno. Por que relacionamentos terminam, segundo Darwin. Disponível em
https://super.abril.com.br/ciencia/amor-o-fim/. Acesso em 2 de abril de 2023 [com supressões].
I. A expressão „por sua vez‟ estaria também corretamente empregada se estivesse entre duas vírgulas;
II. O trecho „a produção de dopamina – ironicamente, fazendo a pessoa se sentir ainda mais apaixonada‟ pode ser assim reescrito: „a produção de dopamina, que, ironicamente, faz a pessoa se sentir ainda mais apaixonada‟;
III. O vocábulo „pânico‟ é acentuado obrigatoriamente por se tratar de uma proparoxítona.
Marque a opção CORRETA:
Leia o texto que segue e responda à questão.
Por que relacionamentos terminam, segundo Darwin


Callegari, Jeanne e Garattoni, Bruno. Por que relacionamentos terminam, segundo Darwin. Disponível em
https://super.abril.com.br/ciencia/amor-o-fim/. Acesso em 2 de abril de 2023 [com supressões].
I. No trecho „ligadas a comportamentos agressivos e sexuais‟, o vocábulo „a‟ deve receber um acento grave;
II. No trecho „, como a amígdala e o hipotálamo‟, a vírgula antes do vocábulo „como‟ não cumpre nenhuma função, logo deve ser dispensada;
III. No trecho „o sulco temporal posterior superior, associado à percepção de emoções nas outras pessoas‟, o uso do acento grave se justifica porque o vocábulo „superior‟ exige a preposição „a‟ e o vocábulo „percepção‟ admite a anteposição do artigo feminino „a‟.
Marque a opção CORRETA:
Leia o texto que segue e responda à questão.
Por que relacionamentos terminam, segundo Darwin


Callegari, Jeanne e Garattoni, Bruno. Por que relacionamentos terminam, segundo Darwin. Disponível em
https://super.abril.com.br/ciencia/amor-o-fim/. Acesso em 2 de abril de 2023 [com supressões].
I. A expressão „Em 2006‟ está virgulada porque está deslocada e indica tempo; II. O nome próprio Hidehiko Takahashi cumpre uma função exemplificativa; III. O pronome „que‟ se relaciona sintático-semanticamente com o trecho mais próximo: „de homens e mulheres‟.
Marque a opção CORRETA:
Após a leitura, assinale a opção que mostra O SOMATÓRIO DOS COEFICIENTES ESTEQUIOMÉTRICOS, expressos com os menores inteiros, da reação citada na etapa 1 acima, A GEOMETRIA MOLECULAR da arsina e o ESTADO DE OXIDAÇÃO (Nox) do arsênio no ácido arsênico, respectivamente:
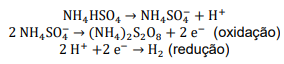
A hidrólise do persulfato de amônio forma H2O2:
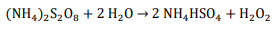
Se a eficiência do processo eletrolítico é de 60% assinale a opção que mostra a INTENSIDADE DE CORRENTE necessária para produzir 97 g de H2O2 por hora: Dados eventualmente necessários: constante de Faraday = 96500 C/mol; massas molares (g/mol): N = 14; O = 16; H = 1; S = 32.
I. Suporta elevadas temperaturas, tem formato arredondado e permite aquecimento uniforme. Essa vidraria é utilizada em processos de destilação, sistemas de evaporação a vácuo e refluxo;
II. É utilizada para medição de volumes, em que não é requerida precisão, e a presença de um bico facilita a transferência de líquidos. Essa vidraria é de uso geral e é útil para realizar misturas e dissolver substâncias em experimentos;
III. É utilizada para medir e transferir líquidos, podendo ser possível controlar o escoamento do material, rápido ou por gotejamento, pois a torneira na extremidade da vidraria permite fazer esse controle. Essa vidraria é amplamente utilizada em titulações, para comportar a substância titulante;
IV. É utilizada para preparar soluções, armazená-las e realizar experimentos que necessitem de aquecimento. Em processos de titulação, essa vidraria geralmente é utilizada para comportar a substância que vai ser titulada.
Com base na análise dos itens I a IV, assinale a opção CORRETA:
Na sequência o iodo foi titulado com tiossulfato de sódio a 0,100 mol/L até o ponto final, com o gasto de 30,00 mL de titulante. Esta última reação foi: I2 + 2 S2O2-3(aq) ➝ 2 I-(aq) + S4O2-6(aq).
Diante das informações, assinale a opção que mostra A PORCENTAGEM EM MASSA DE ZINCO NA AMOSTRA de latão: Dados: massas molares (g/mol): Cu = 63,5; Zn = 65,4.
I. A uma temperatura fixa, uma solução aquosa saturada de um determinado soluto sempre contém uma quantidade fixa desse soluto;
II. Todos os líquidos fervem a uma temperatura superior ao seu ponto de ebulição normal quando contêm impurezas não voláteis;
III. Toda solução comporta-se como uma solução ideal.
Com base na análise dos itens I, II e III, assinale a opção CORRETA:
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
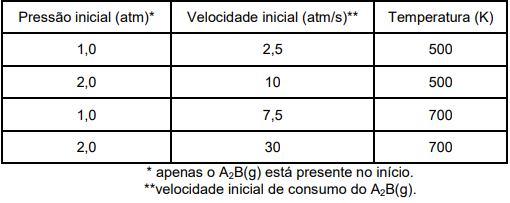
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K:
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.
Diante dessas informações, assinale a opção que mostra O VALOR DA CONSTANTE DE EQUILÍBRIO, Kp, para a reação de dimerização e a afirmação CORRETA que expressa a influência da pressão (FAVORECE OU DESFAVORECE) na dimerização:
Figura: Dados cinéticos para uma reação de primeira ordem. Concentração versus tempo e velocidade versus tempo.
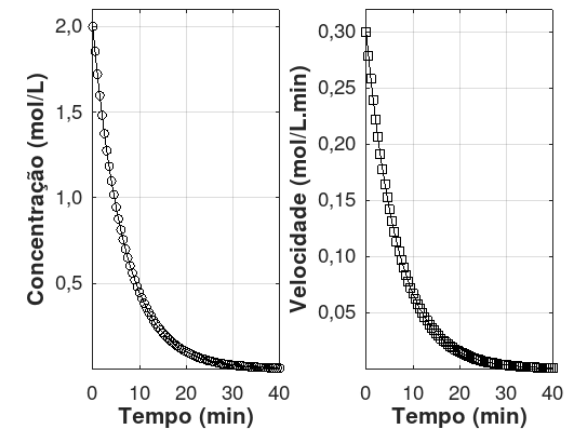
A partir da interpretação dos gráficos mostrados acima, assinale a opção que mostra corretamente O VALOR DO TEMPO DE MEIA-VIDA do processo, em minutos, com precisão de duas casas decimais: Dado: considere ln(2) = 0,693.
No contexto exposto acima, assinale a ÚNICA opção que contém o nome de um composto carbonílico que NÃO gera o íon enolato na presença de uma base forte:
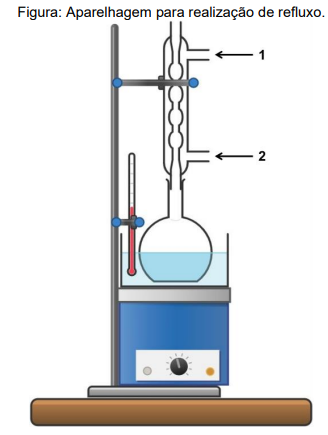
Sobre a técnica citada acima, sua aparelhagem mostrada e demais aspectos relacionados, assinale a opção CORRETA: