Questões de Concurso
Foram encontradas 8.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Julgue o item subsequente, acerca da diluição de compostos utilizados na limpeza de vidrarias de laboratório.
Para o preparo de uma solução de detergente a partir de
concentrado em pó, cuja instrução de preparo seja a diluição
para 20% p/v, deve-se adicionar 20 mL do pó e 80 mL de
água.
Julgue o item subsequente, acerca da diluição de compostos utilizados na limpeza de vidrarias de laboratório.
Um frasco que contenha 10 mL de detergente na concentração
de 0,5 mol/L deve ter todo seu volume acrescentado a 10 mL
de água, caso a concentração de uso seja 0,25 mol/L.
Julgue o item a seguir, relativos às técnicas de limpeza de vidrarias.
A forma mais adequada de lavar e enxaguar recipientes de
vidro estreitos, como tubos ou cubetas, é deixá-los em imersão
por 5 minutos na solução de ácido sulfúrico a 5% e,
posteriormente, submetê-los a um jato de água quente com
fluxo pouco intenso.
Julgue o item a seguir, relativos às técnicas de limpeza de vidrarias.
A solução de ácido fluorídrico é a mais adequada para a
limpeza de balões volumétricos de precisão, pois remove os
contaminantes com maior eficiência.
Julgue o item a seguir, relativos às técnicas de limpeza de vidrarias.
Quando uma superfície de vidro que esteja limpa entra em
contato com a água, ocorre a formação de pequenas gotículas.
Caso a água se espalhe uniformemente sobre a superfície,
significa que a superfície está contaminada.
Julgue o item a seguir, relativos às técnicas de limpeza de vidrarias.
A escovação com água e sabão é uma técnica usual e adequada
para a limpeza de pipetas graduadas de 1 mL.
Com relação aos diversos aspectos de limpeza de vidrarias utilizadas com materiais lipídicos, proteínas alimentares e misturas de carboidratos, julgue o item que se segue.
Para a remoção da sacarose aderida nas vidrarias é necessário
o uso de compostos anfipáticos, em função da reduzida
polaridade dos carboidratos.
No que concerne à titulometria, julgue o item que se segue.
O excepcional poder quelante do EDTA oferece uma vantagem e
uma desvantagem no que se refere a titulações complexométricas.
Se, por um lado, ele torna o EDTA um reagente extremamente
versátil, que pode ser utilizado na determinação de diversos
cátions di, tri e tetravalentes, por outro lado, faz dele um titulante
muito pouco seletivo. Essa desvantagem pode ser minimizada
mediante um controle preciso do pH.
No que concerne à titulometria, julgue o item que se segue.
O permanganato de potássio tem sido a cada dia mais utilizado
como titulante em volumetria de oxirredução, pelo seu alto poder
oxidante, além de apresentar grande precisão nas titulações.
A respeito dos conceitos relativos à química inorgânica, julgue o seguinte item.
O complexo neutro Co(NH3)3(NO2)3 possui apenas dois isômeros.
A respeito dos conceitos relativos à química inorgânica, julgue o seguinte item.
Compostos iônicos são normalmente sólidos à temperatura
ambiente, possuem pontos de fusão geralmente altos e são bons
condutores de corrente elétrica quando fundidos ou em solução
aquosa. A maioria dos compostos iônicos é solúvel em água e
insolúvel em solventes apolares orgânicos.
A respeito dos conceitos relativos à química inorgânica, julgue o seguinte item.
Se uma quantidade significativa de cal virgem (CaO) for
adicionada a uma solução aquosa de fenolftaleína, o resultado será
uma solução incolor.
A respeito dos conceitos relativos à química inorgânica, julgue o seguinte item.
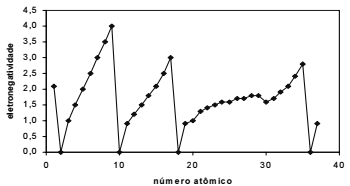
O gráfico abaixo permite concluir que a eletronegatividade é uma propriedade periódica.
Sprays de ninidrina têm sido utilizados por peritos criminais para auxiliar na visualização de impressões digitais. A ninidrina reage com os aminoácidos da impressão digital e forma um produto azul-violeta, denominado púrpura de Ruhemann, que revela a impressão digital quando iluminado. A partir dessas informações, da reação mostrada acima e sabendo-se que M(H) = 1 g/mol, M(C) = 12 g/mol, M(O) = 16 g/mol, julgue o item a seguir, considerando que o volume molar de um gás ideal nas CNTP é igual a 22,7 L/mol.
A conversão de 1 g de ninidrina em púrpura de Ruhemann a 0ºC
e 1 atm lança na atmosfera menos de 200 mL de CO2,
admitindo-se um comportamento ideal do gás e um sistema aberto.
Sprays de ninidrina têm sido utilizados por peritos criminais para auxiliar na visualização de impressões digitais. A ninidrina reage com os aminoácidos da impressão digital e forma um produto azul-violeta, denominado púrpura de Ruhemann, que revela a impressão digital quando iluminado. A partir dessas informações, da reação mostrada acima e sabendo-se que M(H) = 1 g/mol, M(C) = 12 g/mol, M(O) = 16 g/mol, julgue o item a seguir, considerando que o volume molar de um gás ideal nas CNTP é igual a 22,7 L/mol.
A reação entre o produto de desidratação da ninidrina e o
aminoácido pode ser corretamente classificada como uma adição
nucleofílica ao grupo carbonila.
Sprays de ninidrina têm sido utilizados por peritos criminais para auxiliar na visualização de impressões digitais. A ninidrina reage com os aminoácidos da impressão digital e forma um produto azul-violeta, denominado púrpura de Ruhemann, que revela a impressão digital quando iluminado. A partir dessas informações, da reação mostrada acima e sabendo-se que M(H) = 1 g/mol, M(C) = 12 g/mol, M(O) = 16 g/mol, julgue o item a seguir, considerando que o volume molar de um gás ideal nas CNTP é igual a 22,7 L/mol.
Pelo menos uma das substâncias mostradas na reação é uma amida.
Sprays de ninidrina têm sido utilizados por peritos criminais para auxiliar na visualização de impressões digitais. A ninidrina reage com os aminoácidos da impressão digital e forma um produto azul-violeta, denominado púrpura de Ruhemann, que revela a impressão digital quando iluminado. A partir dessas informações, da reação mostrada acima e sabendo-se que M(H) = 1 g/mol, M(C) = 12 g/mol, M(O) = 16 g/mol, julgue o item a seguir, considerando que o volume molar de um gás ideal nas CNTP é igual a 22,7 L/mol.
O aminoácido mostrado na reação é um $-aminoácido secundário.
Considere a seguinte situação hipotética.
Uma enfermeira é suspeita de ter trocado deliberadamente o conteúdo de um frasco de remédio, retirando a droga nele contida e substituindo-a por solução salina. Um agente policial submeteu o frasco em questão, que continha no rótulo a informação “meperidina 20 mg/mL”, a análise forense. O químico pipetou 100 μL da solução contida no frasco e a diluiu em H2SO4 0,5 mol/L até atingir o volume de 10,0 mL. Após agitar a solução, essa foi colocada em uma cubeta de 1 cm e um espectro de UV-VIS foi registrado. O químico observou que o espectro obtido era qualitativamente similar ao espectro de referência da meperidina e que a absorvância a 257 nm era igual a 0,075.
Nessa situação, sabendo-se que a absortividade molar da meperidina a 257 nm é igual a 0,85 L × g-1 × cm-1 em solução ácida e que a sua massa molar é igual a 247,3 g/mol, julgue o item subseqüente.
Admitindo que o químico tenha utilizado uma solução comercial de
ácido sulfúrico 49% em massa, de densidade igual a 1,39 g/mL, para
preparar a solução de H2SO4 usada nessa determinação, e sabendo que
M(H) = 1 g/mol, M(O) = 16 g/mol e M(S) = 32 g/mol, é correto
concluir que foi pipetado pelo químico menos de 5 mL dessa solução
para preparar 100 mL de solução de H2SO4 0,5 mol/L.
Considere a seguinte situação hipotética.
Uma enfermeira é suspeita de ter trocado deliberadamente o conteúdo de um frasco de remédio, retirando a droga nele contida e substituindo-a por solução salina. Um agente policial submeteu o frasco em questão, que continha no rótulo a informação “meperidina 20 mg/mL”, a análise forense. O químico pipetou 100 μL da solução contida no frasco e a diluiu em H2SO4 0,5 mol/L até atingir o volume de 10,0 mL. Após agitar a solução, essa foi colocada em uma cubeta de 1 cm e um espectro de UV-VIS foi registrado. O químico observou que o espectro obtido era qualitativamente similar ao espectro de referência da meperidina e que a absorvância a 257 nm era igual a 0,075.
Nessa situação, sabendo-se que a absortividade molar da meperidina a 257 nm é igual a 0,85 L × g-1 × cm-1 em solução ácida e que a sua massa molar é igual a 247,3 g/mol, julgue o item subseqüente.
A absorvância medida pelo químico indica que a concentração de
meperidina na solução analisada é realmente de 20 mg/mL, resultado
que isentaria a enfermeira de culpa.
Considere a seguinte situação hipotética.
Uma enfermeira é suspeita de ter trocado deliberadamente o conteúdo de um frasco de remédio, retirando a droga nele contida e substituindo-a por solução salina. Um agente policial submeteu o frasco em questão, que continha no rótulo a informação “meperidina 20 mg/mL”, a análise forense. O químico pipetou 100 μL da solução contida no frasco e a diluiu em H2SO4 0,5 mol/L até atingir o volume de 10,0 mL. Após agitar a solução, essa foi colocada em uma cubeta de 1 cm e um espectro de UV-VIS foi registrado. O químico observou que o espectro obtido era qualitativamente similar ao espectro de referência da meperidina e que a absorvância a 257 nm era igual a 0,075.
Nessa situação, sabendo-se que a absortividade molar da meperidina a 257 nm é igual a 0,85 L × g-1 × cm-1 em solução ácida e que a sua massa molar é igual a 247,3 g/mol, julgue o item subseqüente.
O espectro de UV-VIS indica que o frasco cujo conteúdo foi analisado
contém, muito provavelmente, meperidina.
