Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Sobre as enzimas e lipídeos, analise:
I. Os lipídeos são ésteres formados por reação entre ácidos graxos e glicerol.
II. Substâncias lipídicas são solúveis em solventes orgânicos por possuírem cadeias carbônicas hidrófobas.
III. As enzimas são proteínas especiais que atuam sobre substratos específicos e sua funcionalidade aumenta de maneira proporcional à temperatura.
IV. A atividade enzimática depende, entre outros fatores do pH, da temperatura e da presença de substâncias estereoquimicamente análogas ao substrato e, portanto, capazes de se ligar ao sítio ativo.
Podem ser consideradas INCORRETAS apenas as afirmativas:
Sobre a Cromatografia Líquida de Alta Eficiência (CLAE), marque V para as afirmativas verdadeiras e F para as falsas:
( ) A CLAE limita-se à análise quantitativa de substâncias em diversos tipos de matrizes.
( ) É uma técnica bastante rápida e com grande reprodutibilidade e sensibilidade.
( ) Apesar de ser necessário o uso de solventes extremamente puros é uma técnica de baixo custo.
( ) Pode ser aplicada na quantificação de analitos polares e apolares não ionizáveis.
A seqüência está correta em:
Sobre os carboidratos, analise:
I. São poliálcoois.
II. Podem possuir funções mistas.
III. É comum encontrar as funções aldeído ou cetona.
Estão corretas apenas as afirmativas:
De acordo com o princípio de Le Chatellier, quando se exerce uma ação sobre determinado sistema em equilíbrio, há maior tendência de reação em um dos sentidos. A decomposição do calcário ocorre de acordo com a representação ao lado:
CaCO3(s) ⇌ CaO(s) + CO2(g)
Sobre o equilíbrio envolvendo essa reação, pode-se afirmar corretamente que:
A soma dos menores coeficientes estequiométricos inteiros que tornam a equação:
MnO4 – (aq) + H+ (aq) + Fe2+ (aq) → Mn2+ (aq) + Fe3+ (aq) + 4H2O(ℓ) corretamente balanceada é:
I. Nos espectros de RMN de 1 He 13C podem-se obter boas indicações de como os átomos se encontram ligados em estruturas muitas vezes bastante complexas. II. A posição de cada átomo de hidrogênio num espectro de RMN de 1 H depende, entre outros fatores, da eletronegatividade de átomos vizinhos. III. Na preparação de amostras a serem introduzidas num aparelho de RMN, normalmente são utilizados solventes especiais em alto grau de pureza. IV. O tetrametilssilano (TMS) é muito utilizado como padrão interno em equipamentos de RMN.
Estão corretas apenas as afirmativas:
I. A presença de bandas espectrais na região de 3500cm-1 pode indicar que a molécula possui grupamento OH. II. A presença de carbonilas pode ser verificada pela presença de fortes bandas na região de 2800cm-1. III. O uso desta técnica possibilita a dedução da fórmula estrutural completa das substâncias químicas já que indica os grupos funcionais presentes. IV. O uso dos espectros de infravermelho poderá contribuir em estudos de ligações de hidrogênio formadas por grupamentos NH e OH.
São INCORRETAS apenas as afirmativas:
A questão é baseada na seqüência de reações abaixo:

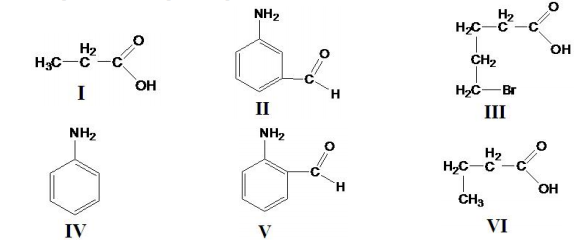
4Aℓ(s) + 3O2(g) → 2Aℓ2O3(s)
I. É utilizada na determinação da massa molecular de substâncias químicas contendo poucos átomos. II. O pico do íon molecular corresponde à massa do fragmento mais estável da molécula. III. Na técnica do impacto de elétrons, o equipamento bombardeia moléculas da amostra na fase de vapor com um feixe de elétrons de alta energia e registra o resultado como um gráfico contínuo cujo valor máximo no eixo y corresponde à massa molecular da substância analisada. IV. Os picos de massas podem ser produzidos por rearranjos ocorridos com fragmentos menos estáveis da amostra.
Está(ão) INCORRETA(S) apenas a(s) afirmativa(s):