Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Estudo demostra que algumas espécies já nascem com uma "proteção" a inseticidas e a evolução ocorre de forma rápida.
Na “guerra” entre seres humanos e baratas, estes insetos só vão perder (por enquanto) para as chinelas. Um estudo da Universidade de Purdue mostra que elas já estão nascendo resistentes a venenos em spray e o processo ocorre de forma rápida.
Espécies Blattella germanica, comumente encontradas na Alemanha, já vêm ao mundo com “proteção evoluída” a produtos químicos com os quais elas ainda nem tiveram contato, processo evolutivo chamado de resistência cruzada. Os filhotes não só resistiram ao pesticida a que seus pais foram expostos, como, inesperadamente, mostraram sinais de resistência a outras classes de inseticidas.
A equipe se surpreendeu com a forma rápida com que esse upgrade ocorreu e destacou que, em um futuro nada distante, elas serão praticamente imunes a produtos químicos.
(Adaptado de: https://www.metropoles.com/mundo/ciencia-e-tecnologia-int/baratas-estao-evoluindo-e-podem-se-tornar-quase-im- possiveis-de-matar)
Os inseticidas que apresentam os melhores resultados são aqueles que possuem uma mistura de três compostos ativos, a saber:
Tabela 1 − Concentração de princípios ativos (substâncias componentes) do inseticida está de acordo com o declarado pelo fabricante, na embalagem do produto.
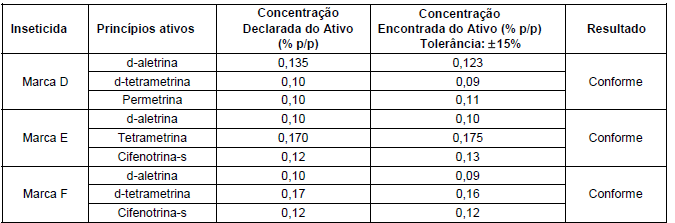
(Disponível em: http://www.inmetro.gov.br/consumidor/produtos/inseticida.asp)
Em comum, as três marcas apresentam o componente tetrametrina, cuja molécula encontra-se reproduzida abaixo e sua fórmula química simplificada é C19H25NO4:
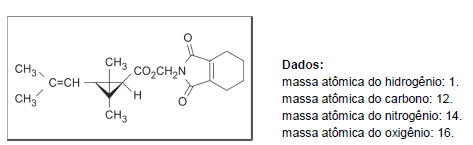
(Disponível em: http://portal.anvisa.gov.br/documents/111215/117782/t58. pdf/3330eb77-2386-4b4f-a12f-78ad992f6e22)
A massa molecular, o número de instaurações e o número de heteroátomos que podem ser visualizados na figura são, respectivamente:
O volume necessário da base, sabendo que o efluente tem o volume de 2500 L e concentração 0,500 mol/L, é
I. Tempo de meia-vida biológico
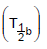 II. Tempo de meia-vida efetivo
II. Tempo de meia-vida efetivo 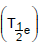 III. Tempo de meia-vida físico ou da partícula
III. Tempo de meia-vida físico ou da partícula 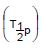
A figura abaixo ilustra o decaimento do estrôncio 85, após ter sido injetado em uma pessoa.
Decaimento do radionuclídeo em um paciente
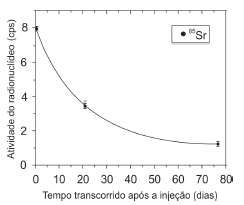
(Adaptado de: Haquin et al., 2004. Biological Half-Life Measurements of Radioactive Strontium in Hormonal-Resistant Prostate Cancer Patients)
Sabendo que o tempo de meia-vida efetivo representa o tempo necessário para um radionuclídeo (contido em um sistema biológico) reduzir a sua atividade pela metade, um resultado combinado entre o decaimento radioativo e a meia‐vida biológica é expresso por:
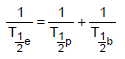
Sabendo que o tempo de meia-vida do Sr-85 vale 1.440 horas, o tempo de meia-vida efetivo aproximado deste radionuclídeo, no interior do paciente que se encontra em tratamento radioterápico é, aproximadamente, igual a
Ela suspeitou que havia se contaminado com um isótopo radioativo do césio. Preocupada, procurou auxílio técnico especializado que constatou que as queimaduras não foram provocadas por radiação ionizante.
Como atualmente esses aparelhos não possuem elementos radioativos, a radiação é do tipo
As figuras abaixo ilustram as estruturas da glicose e da ureia.
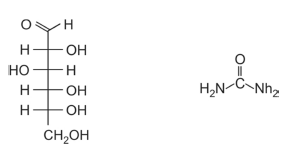
A glicose é um
m = 20/ (152g.mol).(1.0) m = 0,13
Qual tipo de isomeria a figura representa?
HOOC(CHOH)2 COOH + 2NaOH ↔ NaOOC(CHOH)2 COOHNa + H2 O
Dados: massa molar do H=1g/mol, O=16g/mol, C=12g/mol e Na=23 g/mol.